Este documento resume los principales conceptos de la cinética química. Explica que la cinética química estudia la velocidad de las reacciones químicas y los factores que la afectan. Define la velocidad de reacción, distinguiendo entre velocidad media e instantánea. Describe teorías como la de colisiones y el complejo activado. Finalmente, detalla factores que influyen en la velocidad como la naturaleza de los reactivos, la temperatura, la concentración y la superficie de contacto.






![UNIVERSIDAD NACIONAL FEDERICO VILLARREAL
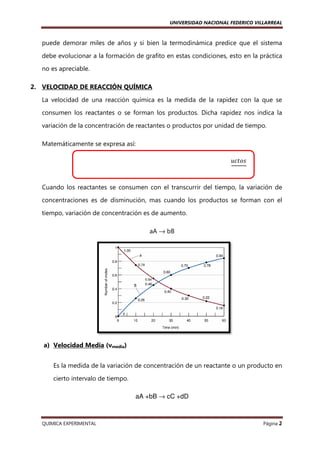
v = k [A]
Primer orden respecto a A. Orden total 1
v = k [A] [B]
Primer orden respecto a A y B. Orden total 2
v = k [A]2
Segundo orden respecto a A. Orden total 2
v = k [A]2 [B]
Segundo orden respecto a A y primero respecto a B.
Orden total 3
v=k
Orden total cero
Nota: y, x y k no tienen por qué guardar relación con los coeficientes de la
ecuación
química
ajustada
para
la
reacción
global,
se
determinan
experimentalmente.
Algunas características de la Ley de la Velocidad son:
Las leyes de la velocidad siempre se determinan experimentalmente y a
partir de las concentraciones de los reactantes y la velocidad de reacción
inicial es posible determinar el orden de la reacción y la constante k.
El orden de una reacción se define en función de las concentraciones de
los reactivos (no de los reactantes).
Se mide los efectos de la concentración en la velocidad al inicio porque
luego es muy difícil medir la variación de la concentración porque la
reacción puede llegar al equilibrio o invertirse, además las variaciones se
hacen cada vez más pequeñas y puede existir error al momento de
medirlas.
Ejemplo:
Determinar el orden de reacción: CH3-Cl (g) + H2O (g) → CH3-OH (g) + HCl (g)
usando los datos de la tabla.
QUIMICA EXPERIMENTAL
Página 12](https://image.slidesharecdn.com/cinticaquimica-131210155902-phpapp01/85/CINETICA-QUIMICA-12-320.jpg)
![UNIVERSIDAD NACIONAL FEDERICO VILLARREAL
v = k · [CH3-Cl ]n · [H2O]m
En las experiencias 1 y 2 vemos que no cambia [H2O] luego el cambio de “v” se
debe al cambio de [CH3-Cl]. Como al doblar [CH3-Cl] se dobla la velocidad
podemos deducir que el orden de reacción respecto del CH3-Cl es “1”.
Cl
En las experiencias 1 y 3 vemos que no cambia [CH3-Cl] luego el cambio de “v”
se debe al cambio de [H2O]. Como al doblar [H2O] se cuadruplica la velocidad
podemos deducir que el orden de reacción respecto del H2O es “2”.
v = k · [CH3-Cl ] · [H2O]2
Y el orden total de la reacción es “3”. El valor de “k” se calcula a partir de
cualquier experiencia y resulta 181’4 mol–2l2s –1.
Tiempo de vida media ࢚ቀቁ :
Es el tiempo que debe transcurrir para que la concentración final sea la mitad de
la concentración inicial.
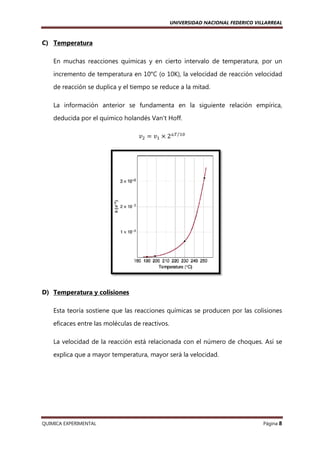
F) Reacciones de Orden Cero
Sea la reacción elemental:
aA → producto
Se tiene la ecuación de la velocidad: ݒൌ ݇ሾܣሿ ൌ ݇
Se deduce que la velocidad no depende de la concentración del reactante.
Asimismo se puede obtener una recta a partir de la ecuación anterior:
QUIMICA EXPERIMENTAL
Página 13](https://image.slidesharecdn.com/cinticaquimica-131210155902-phpapp01/85/CINETICA-QUIMICA-13-320.jpg)
![UNIVERSIDAD NACIONAL FEDERICO VILLARREAL
ሾሿ
ሾ
௧
݀ሾܣሿ
ሾܣሿ ᇧ ᇧᇤᇧ ሾܣሿ
ݒൌെ
ൌ ݇ ⇒ െ න ݀ሾܣሿ ൌ න ݇ܽ ݀ ⇒ ݐሾܣሿ െ ሾܣሿ ൌ ܽ݇ ⇒ ݐሾ ܣᇧ ᇧ
ᇣᇧ
ᇣ ൌ െܽ݇ݐᇧ ᇧ
ᇧ ᇧᇥ
ܽ ൈ ݀ݐ
ሾሿ
ሾ బ
௨ó ௗ ௧
௨
ሾܣሿ : concentración inicial de reactivo A.
[A]: concentración en el tiempo.
t: después del comienzo de la reacción.
Unidades de k = mol L-1 s-1
Para hallar el tiempo de vida media hacemos: ሾܣሿ ൌ
ݐቀభ ቁ ൌ
మ
ሾሿబ
ଶ
ሾܣሿ
2ܽ݇
Ejemplo: ܱܥܽܥଷሺ௦ሻ ሱۛۛሮ ܱܽܥሺ௦ሻ ܱܥଶሺሻ ; ݒൌ ݇ሾܱܥܽܥଷ ሿ ൌ ݇
ሮ
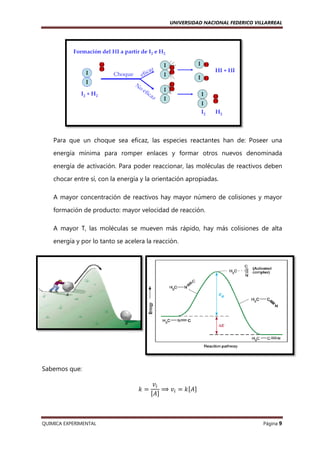
G) Reacciones de Primer Orden
Sea la reacción elemental:
Se tiene la ecuación de la velocidad:
aA → producto
ݒൌ ݇ሾܣሿ
Se deduce que la velocidad depende de la concentración del reactante en forma
lineal. Asimismo se puede obtener una recta a partir de la ecuación anterior:
ݒൌെ
ሾሿ
ሾ
௧
ሾܣሿ
݀ሾܣሿ
݀ሾܣሿ
ሾ ᇧᇧᇧᇧᇧᇤᇧᇧᇧᇧᇧᇧᇥ
ሿ
ൌ ݇ሾܣሿ ⇒ െ න
ൌ න ݇ܽ ݀ ⇒ ݐln
ൌ ܽ݇ ⇒ ݐᇣᇧᇧ ൌ െܽ݇ ݐ lnሾܣሿ
lnሾܣሿ
ሾܣሿ
ܽ ൈ ݀ݐ
ሾ ሿ
ሾሿబ ሾܣሿ
௨ó ௗ ௧
௨
De donde se deduce que las unidades de k = s-1
QUIMICA EXPERIMENTAL
Página 14](https://image.slidesharecdn.com/cinticaquimica-131210155902-phpapp01/85/CINETICA-QUIMICA-14-320.jpg)

![UNIVERSIDAD NACIONAL FEDERICO VILLARREAL
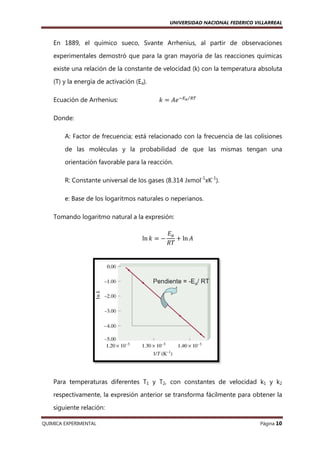
Un proceso elemental es una transformación molecular que modifica de forma
importante la energía o geometría de una molécula o produce una o más nuevas
moléculas.
2NO(g) + O2 (g) → 2NO2(g)
Se ha detectado la presencia de N2O2 durante la reacción:
Reacción elemental 1:
NO + NO → N2O2
Reacción elemental 2:
N2O2 + O2 → 2NO2
Reacción global:
2NO + O2 → 2NO2
En función del número de moléculas que reaccionan en una reacción elemental,
tenemos procesos:
Unimoleculares:
A →Productos
Bimoleculares:
A + B →Productos v= k[A][B]
2 A → Productos
Trimoleculares:
v= k[A]
v= k[A]2
A + B + C → Productos
v= k[A][B][C]
A + 2B → Productos
v= k[A][B]2
Los procesos elementales tienen una serie de características:
En general podemos decir que la velocidad de una etapa elemental es igual a
la constante de velocidad, k, multiplicada por la concentración de cada
molécula de reactivo.
El orden de reacción de la ley de velocidad y los coeficientes estequiométricas
para una reacción elemental coinciden.
Los procesos elementales son reversibles.
Las especies que aparecen en un proceso elemental y se consumen en otro se
conocen como intermedios de reacción. No aparecen en la reacción global.
QUIMICA EXPERIMENTAL
Página 17](https://image.slidesharecdn.com/cinticaquimica-131210155902-phpapp01/85/CINETICA-QUIMICA-17-320.jpg)
![UNIVERSIDAD NACIONAL FEDERICO VILLARREAL
El proceso elemental que transcurre más lentamente controla la velocidad de
la reacción global y recibe el nombre de etapa determinante de la velocidad.
La ley de velocidad global queda determinada por la ley de velocidad
correspondiente al paso más lento.
Ejemplo:
La reacción NO2 (g) + CO (g) → NO (g) + CO2 (g) sucede en dos etapas:
1ª etapa (lenta):
2NO2 → NO + NO3
2ª etapa (rápida):
NO3 + CO → NO2 + CO2
La reacción global es la suma de las dos. Además el NO3 es un intermedio de
reacción y en la etapa lenta intervienen dos moléculas de NO2.
Luego v = k · [NO2]2
6. CATALIZADORES
La catálisis es el proceso por el cual se aumenta o disminuye la velocidad de
una reacción
química,
debido
a
la
participación
de
una
sustancia
llamada catalizador.
Las sustancias que reducen la velocidad de la reacción son denominados
«catalizadores negativos» o «inhibidores». A su vez, las sustancias que aumentan la
actividad de los catalizadores son denominados «catalizadores positivos» o
«promotores», y las que desactivan la catálisis son denominados «venenos
catalíticos».
La elaboración de los productos químicos industriales más importantes implica a la
catálisis. Por ejemplo, en la reducción del etino a eteno, el catalizador paladio (Pd)
es "envenenado" parcialmente con acetato de plomo (II), Pb(CH3COO)2. Sin la
QUIMICA EXPERIMENTAL
Página 18](https://image.slidesharecdn.com/cinticaquimica-131210155902-phpapp01/85/CINETICA-QUIMICA-18-320.jpg)







