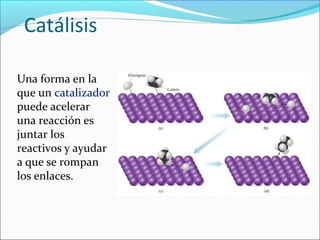
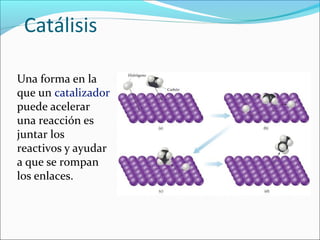
La cinética estudia la velocidad de los procesos químicos. La velocidad de reacción depende de factores como la concentración de los reactivos, la temperatura y la presencia de catalizadores. La cinética puede determinar el orden de una reacción y expresar matemáticamente cómo afectan estos factores a la velocidad a través de leyes de velocidad y la constante de velocidad.


![Cinética química
La velocidad de reacción es el cambio de la concentración
de un reactante o un producto por unidad de tiempo (M/s).
A B
∆[A] ∆[A] = Cambio de concentración en A
V=- respecto a un periodo de tiempo ∆t.
∆t
∆[B] ∆[B] = Cambio de concentración en B
V=
∆t respecto a un periodo de tiempo ∆t.
Porque [A] decrece con el tiempo, ∆[A] es negativo.
13.1](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-3-320.jpg)
![A B
Tiempo
∆[A]
V=-
∆t
∆[B]
V=
∆t
13.1](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-4-320.jpg)

![Br2 (ac) + HCOOH (ac) 2Br- (ac) + 2H+ (ac) + CO2 (g)
Pendiente de
la tangente
Pendiente
de Pendiente de
la tangente la tangente
∆[Br2] [Br2]final – [Br2]inicial
Velocidad promedio= - =-
∆t tfinal - tinicial
Velocidad instantánea =Velocidad en un tiempo específico
13.1.](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-6-320.jpg)
![Velocidad α [Br2]
Velocidad = k [Br2]
V
k= =Velocidad cte.
[Br2]
= 3.50 x 10-3 s-1
13.1](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-7-320.jpg)
![Velocidades de reacción y
estequiometría
¿Qué pasa si la relación no es 1:1?
2 HI(g) → H2(g) + I2(g)
•En tal caso,
1 ∆[HI] ∆[I2]
Velocidad = − =
2 ∆t ∆t](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-8-320.jpg)

![Ejercicio
¿Cuál es la relación entre la velocidad de desaparición
del ozono y la velocidad de aparición del oxígeno en
la ecuación?
2 O3 (g) → 3 O2
Si la velocidad de aparición de O2 ∆[O2]/∆t es de 6 x
10-5 M/s en un instante determinado ¿cuál es el valor
de la velocidad de aparición de O3, -∆[O3]/∆t en ese
momento?](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-10-320.jpg)


![Concentración y velocidad
NH4+(ac) + NO2−(ac) N2(g) + 2 H2O(l)
Si se comparan los experimentos 1 y 2, se
observa que cuando se duplica [NH4+], la
velocidad inicial se duplica.](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-13-320.jpg)
![Concentración y velocidad
NH4+(ac) + NO2−(ac) N2(g) + 2 H2O(l)
Asimismo, cuando se comparan los
experimentos 5 y 6, se observa que cuando se
duplica [NO2−], la velocidad inicial se duplica.](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-14-320.jpg)
![Concentración y velocidad
Esto significa que:
Velocidad ∝ [NH4+]
Velocidad ∝ [NO2−]
Por lo tanto, Velocidad ∝ [NH+] [NO2−]
• Lo cual, cuando se escribe como una ecuación
se vuelve:
Velocidad = k [NH4+] [NO2−]
A esta ecuación se le llama ley de velocidad,
y k es la constante de velocidad.](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-15-320.jpg)
![Leyes de velocidad
Una ley de velocidad muestra la relación entre la
velocidad de la reacción y las concentraciones de los
reactivos.
Los exponentes indican el orden de la reacción con
respecto de cada reactivo.
Dado que la ley de velocidad es:
Velocidad = k [NH4+] [NO2−]
La reacción es:
de primer orden en [NH4+] y
de primer orden en [NO2−].](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-16-320.jpg)
![Leyes de velocidad
Velocidad = k [NH4+] [NO2−]
El orden general de la reacción puede
encontrarse adicionando los exponentes de
los reactivos en la ley de velocidad.
Esta reacción es de segundo orden general.](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-17-320.jpg)

![Ejercicio
Se midió la velocidad inicial de la reacción A + B → C con
diversas concentraciones iniciales de A y B siendo los resultados
los siguientes
Experimento [A] (M) [B] (M) Velocidad inicial (M/s)
1 0,1 0,1 4 x 10 -5
2 0,1 0,2 4 x 10-5
3 0,2 0,1 16 x 10-5
Con base en estos datos determine
A) ecuación de velocidad de la reacción
B) la magnitud de la constante de velocidad
C) la velocidad de reacción cuando [A] = 0,05M y [B] = 0,1M](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-19-320.jpg)
![Ejercicio
Se midieron los datos siguientes de la reacción del óxido nítrico
con hidrógeno:
2NO(g) + 2H2(g) → N2(g) + 2H2O(g)
Experimento [NO] (M) [H2] (M) Velocidad
inicial (M/s)
1 0,1 0,1 1,23 x 10-3
2 0,1 0,2 2,46 x 10-3
3 0,2 0,1 4,92 x 10-3
a) Determine la ecuación de velocidad de esta reacción
b) Calcule la constante de velocidad
c) Calcule la velocidad cuando [NO]=0,05M y [H2]=0,150M](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-20-320.jpg)


![Efecto del Cambio de la
Concentración
Una forma de estudiar el efecto de la
concentración en la velocidad de reacción
consiste en establecer cómo depende la
velocidad al comienzo de la reacción
(velocidad inicial) de las concentraciones de
partida
La dependencia de la concentración se
expresa:
V = k [R]
Para la reacción (1)
[ ] [ ] m n
V =
k A B (2)
Donde:
K es la constante de velocidad
m y n determinan el orden de reacción (son números enteros
pequeños 0, 1, 2….)](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-23-320.jpg)
![La constante de velocidad y sus
unidades
De lo expuesto anteriormente (2) se deduce que k
depende del orden de reacción
Si Velocidad se expresa en M/s y Concentración en M
Para una reacción de primer orden: k= V/[A] s-1
Para una reacción de segundo orden: k = V/[A] 2 M-1s-1
Para una reacción de tercer orden: k = V/[A]2[B] M-2s-1](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-24-320.jpg)
![Reacción de Primer Orden
∆[ A]
[ A]
∆t
ln[ A] t − ln[ A] 0 = −kt ln
[ A] t = −kt
[ A] 0
ln[ A] t = − kt + ln[ A] 0](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-25-320.jpg)



![Reacciones de Segundo Orden
Es aquella cuya velocidad depende de la concentración de un
reactivo elevada a la segunda potencia o de las concentraciones
de dos reactivos diferentes, cada una elevada a la primera
potencia.
∆[ A]
= k [ A]
2
Velocidad = −
∆t
Si relacionamos la concentración de A al comienzo de la
reacción [A]0 con su concentración en cualquier otro tiempo t,
[A]t 1 1
= kt +
[ A] t [ A] 0
↓ ↓ ↓
Dónde Y = mx + b](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-30-320.jpg)
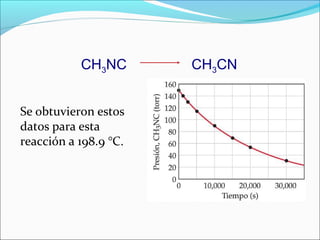
![Ejercicio
Se obtuvieron los siguientes datos de la descomposición
en fase gaseosa de dióxido de nitrógeno a 300°C,
NO2(g) → NO(g) + ½ O2(g)
Tiempo (s) [NO2] (M)
0 0,01000
50 0,00787
100 0,00649
200 0,00481
300 0,00380
Determinar el orden de la reacción con respecto a NO2](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-31-320.jpg)
![Vida media
Vida media se define
como el tiempo
requerido para que
reaccione la mitad de
un reactivo.
Debido a que t1/2 en
[A] es la mitad de [A]
original
[A]t = 0.5 [A]0.](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-32-320.jpg)
![Vida media
Para un proceso de primer orden, esto es:
0.5 [A]0
ln = −kt1/2
[A]0
ln 0.5 = −kt1/2
−0.693 = −kt1/2
0.693
= t1/2
k
NOTA: Por tanto, para un proceso de primer orden la vida
media no depende de [A]0.](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-33-320.jpg)
![Vida media
Para un proceso de segundo orden:
1 1
= kt1/2 +
0.5 [A]0 [A]0
2 1
= kt1/2 +
[A]0 [A]0
2 − 1 = 1 = kt
[A]0 [A]0 1/2
1
= t1/2
k[A]0](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-34-320.jpg)
![Resumen de la cinética de las reacciones de orden
cero, orden uno y orden dos
Tiempo de
Orden Ley de velocidad concentración Vida media
[A]0
0 V=k [A] = [A]0 - kt t½ =
2k
ln2
1 V = k [A] ln[A] = ln[A]0 - kt t½ =
k
1 1 1
2 V = k [A] 2 = + kt t½ =
[A] [A]0 k[A]0
13.3](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-35-320.jpg)






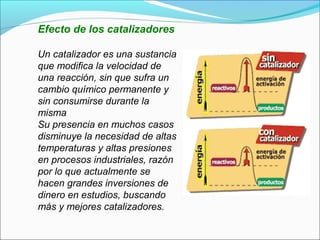






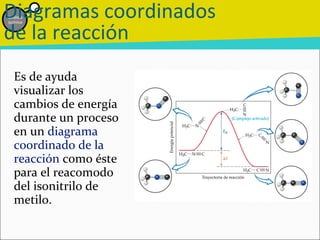


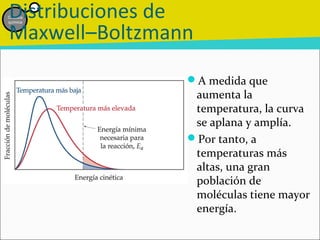








![Etapa inicial lenta
NO2 (g) + CO (g) → NO (g) + CO2 (g)
La ley de velocidad para esta reacción se encontró de
forma experimental como:
Velocidad = k [NO2]2
El CO es necesario para que suceda esta reacción, pero
la velocidad de la reacción no depende de su
concentración.
Esto sugiere que la reacción sucede en dos etapas.](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-62-320.jpg)

![Etapa inicial rápida
2 NO (g) + Br2 (g) → 2 NOBr (g)
La ley de velocidad para esta reacción se
encontró como:
Velocidad = k [NO]2 [Br2]
Debido a que los procesos termomoleculares
son raros, esta ley de velocidad sugiere un
mecanismo de dos etapas.](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-64-320.jpg)

![Etapa inicial rápida
La velocidad de la reacción general depende de
la velocidad de la etapa lenta.
La ley de velocidad para esa etapa sería:
Velocidad = k2 [NOBr2] [NO]
¿Pero cómo determinamos [NOBr2]?](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-66-320.jpg)

![Etapa inicial rápida
Debido a que Velocidadf = Velocidadr ,
k1 [NO] [Br2] = k−1 [NOBr2]
Despejando [NOBr2] tenemos:
k1
[NO] [Br2] = [NOBr2]
k−1](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-68-320.jpg)
![Etapa inicial rápida
La sustitución de esta expresión para [NOBr2] en la
ley de velocidad para la etapa determinante de la
velocidad da:
k2k1
Promedio = [NO] [Br2] [NO]
k−1
= k [NO]2 [Br2]](https://image.slidesharecdn.com/cinetica2bquimica-121118212802-phpapp02/85/Cinetica-2-bquimica-69-320.jpg)