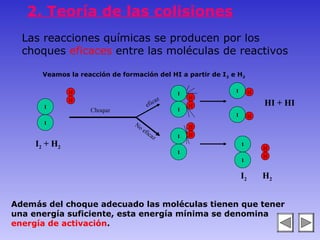
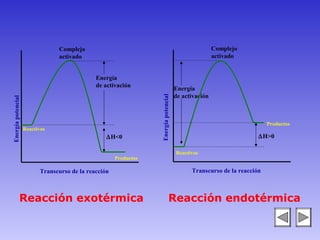
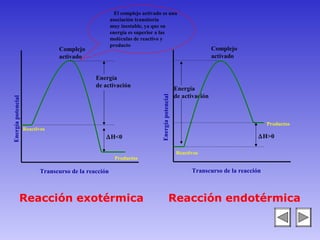
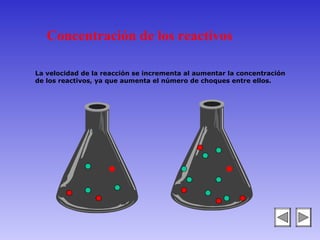
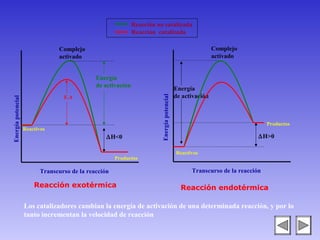
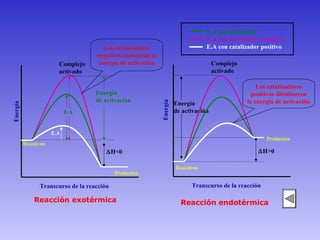
El documento describe los factores que afectan la velocidad de una reacción química. Explica que la velocidad depende de la teoría de colisiones entre moléculas y la energía de activación requerida. Los factores incluyen el estado físico y concentración de los reactivos, la temperatura, y la presencia de catalizadores, los cuales pueden aumentar o disminuir la energía de activación necesaria.

![1.Velocidad de reacción
La velocidad de una reacción química indica cómo varía la concentración
de reactivos o productos con el tiempo
Ejemplo:
Para la reacción
aA + bB cC + dD
La velocidad de la reacción se puede expresar:
1 d [ A] 1 d [ B] 1 d [C ] 1 d [ D]
v =− =− = =
a dt b dt c dt d dt](https://image.slidesharecdn.com/cinetica-120827190645-phpapp01/85/Cinetica-quimica-2-320.jpg)