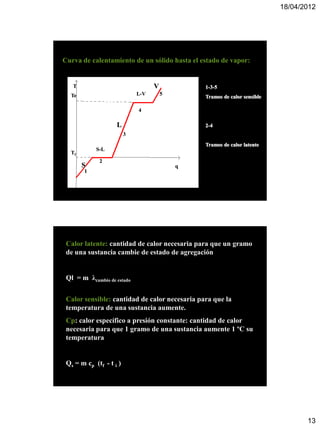
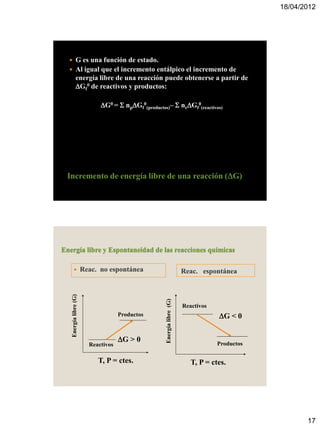
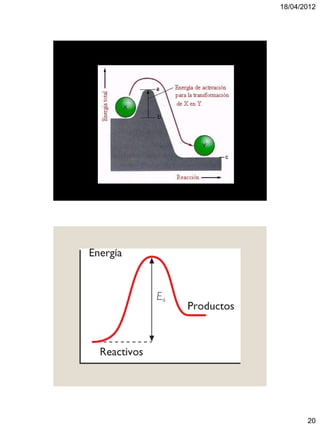
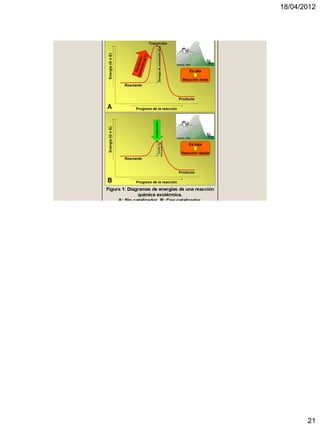
El documento trata sobre termoquímica. Explica que la termoquímica estudia el intercambio energético de sistemas químicos con el exterior. Define conceptos como sistemas abiertos, cerrados y aislados, y reacciones exotérmicas y endotérmicas. También introduce variables de estado, funciones de estado, calor, temperatura y energía interna.