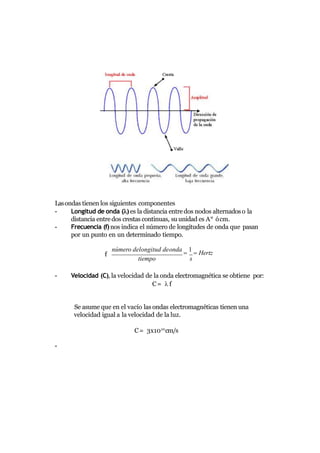
1. El átomo es la célula de un elemento y está constituido principalmente por protones, neutrones y electrones.
2. El núcleo atómico contiene protones y neutrones y posee una carga positiva, mientras que los electrones giran alrededor del núcleo en órbitas y poseen una carga negativa.
3. Los números cuánticos como el número atómico, número de masa y carga determinan las propiedades de cada átomo.













![s
pz px
py
A1
Z x x x
A2 A3
n1 Z n2 Z n3
QUÍMICA GENERAL
Configuración simplificada
Se trata de sustituir una parte de la C.E. por el símbolo de un gas noble.
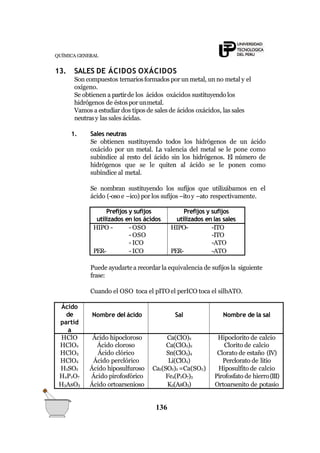
2He 10Ne 18Ar 36Kr 54Xn 86Rn
20Ca: 1s2
2s2
2p6
3s2
4s2
[Ar]: 1s2
2s2
2p6
3s2
20Ca: [Ar]4s2
(configuración electrónica simplificada)
Representación Lewis
- Los electrones de valencia se representan por (.)ó (x)
- Elsímbolo del elemento
Ejem.
7N: 1s2
2s2
2p3
electrones de
valencia: 5
PROBLEMAS RESUELTOS
1. Se tiene un elemento con 3 isótopos cuyos números de masa suman 96
y sus neutrones guardan una progresión aritmética cuya razón es 3 y
suma 36
a) Determinar el número atómico de losisóbaros
b) Determinar el número másico de cadaisótopo
a) Sean losisótopos:
Datos:
A1 + A2+ A3= 96 (1)
n1+n2+n3= 36
n2 =n1 +3
(2)
(3)
n3=n1+3+3=n1 +6 (4)
67](https://image.slidesharecdn.com/clase3quimica-190601161206/85/Clase-3-quimica-15-320.jpg)












![QUÍMICA GENERAL
1s2
2s2
2p6
3s2
3p6
Sumando suselectrones se tiene Z = 18
Respuesta:El número atómico es 18
26. Indiquecual de los siguientes átomos tiene el mayor número de
electrones desapareados o celibatarios:
80
P (Z=15) :I.
II.Ni (Z=28) :
III.K (Z=19) :
IV.Fe (Z=26) : V.
VI.
VII.
Cl (Z=17) :
Mo (Z=42) :
Mn (Z=25)
[Ne] 3s2
3p3
[Ar] 4s2
3d8
[Ar] 4s1
[Ar] 4s2
3d6
[Ne] 3s2
3p5
[Kr]5s2
4d4
: [Ar]4s2
3d5
Respuesta:El Mo: [Kr] 5s2
4d4
[Kr] 5s1
4d5
(6 electrones
celibatarios)
27. El número atómico (Z) de un elemento indica el número de protones y el
número másico (A) indica la suma de protones y neutrones que se
encuentran en un núcleo de un átomo. En general, un elemento X se
representa como: Z n
A
X
De acuerdo a esto, indique cuantos protones, neutrones y electrones
tienen los siguientes elementos:
Al28 32
S 64
Cu 235
U 80
Br13 16 29 92 35
Respuesta: Al (13 p, 15 n y 13 e-
);S(16 p, 16 n y 16 e-
); Cu(29 p,
35 n y 29 e-
); U(92 p, 143 n y 92 e-
); Br(35 p, 45 n y 35e-
)
28. ¿Cuál de los siguientes elementos tiene 4 neutrones más que el
3elemento 7
Li?
I. 11
B5 II.14
N7 III.16
O8 IV. 19
F9 V. 26
Al13
Respuesta:El 7
Li tiene 4 n. El 16
O tiene 8 n (4 más que el Li)
3 8](https://image.slidesharecdn.com/clase3quimica-190601161206/85/Clase-3-quimica-28-320.jpg)











![QUÍMICA GENERAL
42. La suma de los números atómicos de dos Isóbaros es igual a 167 y la
diferencia de sus neutrones es 1 ¿Cuántos neutrones tiene el Isóbaro de
mayor número atómico si este al emitir una partícula a genera un
núcleo con número de masa 210?
43. Un elemento químico posee 2 isótopos con 14 y 16 neutrones
respectivamente. Si la suma de los números de masa es 52. Indique el
nivel y el subnivel más energético en su configuración y sus números
cuánticos.
92
X2-
44. En un anión hay 54 electrones. Determine el número de masa,
si este valor y el número de neutrones están en relación de 32 a 19.
A) 76 B) 52 C) 128 D) 117 E)87
45. La suma del número de electrones de los iones X3+
e Y3–
es 161, si
corresponden a elementos consecutivos de la tabla periódica. ¿Cuál es
la mayor carga nuclear?
46. Indiquelas especies que son isoelectrónicas entre sí:
I. 48Cd2+
IV. 50Sn2+
II. 49In3+
III.47Ag+
V. 51Sb3-
VI. 50Sn4+
SOLUCIONARIO
1. n = 2, l = 1, m = +1, s = + 1/2
2. a)10 b)26 c)13
3. 2,40 x 1012
Erg.
4. a) [Xn]6s2
4f’’
b)4,3,-1, +½
5. – 1,94 x 10-18
J
6. a) 11 b)12
7. a)15 b)1s2
2s2
2p6
3s2
3p3
c) 3,1,+1, +1/2 d) 20
8. a)8500 b)1,989 x 10-26
J
9. 663 nm
10. a) 1s2
2s2
2p6
3s2
3p6
4s2
3d5
b)3, 2, +2, +1/2
11. 6
12. n = 3, l = 1, m= +1, s= -1/2
13. x=1,5410-8
m
14. 24
15. 0,857
16. E= 3,027 x 10-19
J,λ =656 nm](https://image.slidesharecdn.com/clase3quimica-190601161206/85/Clase-3-quimica-40-320.jpg)















![QUÍMICA GENERAL
X-2
tiene 82e-
carga
= #p+
–#e-
-2= #p+
–82 #p+
= 80
en X #p+
= Z = 80
3. Si el ion X+1
es isoelectrónico con un elemento calcógeno y periodo 5
obtener el número de masa del átomo Xsi contiene 74neutrones
Solución:
Calcógeno = 5p4
(s2
, p4
)
Periodo = 5 n = 5 5p4
1s2
2s2
2p6
3s2
3p6
4s2
3d10
4p6
5s2
4d10
5p4
Entonces:
X+1
= 52e-
X0
= (52+1)e-
= 53 p+
= z (en el átomo neutro #p+
= #e-
)
Se obtiene:
A = N° de masa = p+
+ n
= 53 + 74
A = 127
4. El potencial de ionización se define como la energía que se debe
suministrar, a un elemento en estado gaseoso y neutro, para quitarle un
electrón. Indique cual de los elementos que a continuación se
mencionan tiene el menor potencial de ionización:
I. K(Z=19) : [Ne]3s2
3p6
4s1
II. S(Z=16) : [Ne]3s2
3p4
III. Si (Z=14) : [Ne] 3s2
3p2
IV.Al (Z=13) : [Ne]3s2
3p1
V. Na (Z=11) : [Ne] 3s1
Respuesta: El K. El PI disminuye en un grupo y este es el que está
más abajo.
108](https://image.slidesharecdn.com/clase3quimica-190601161206/85/Clase-3-quimica-56-320.jpg)







![QUÍMICA GENERAL
Ejm.Cloruro de sodio, cloruro de calcio, ioduro de plomo
EN
11Na
17Cl
Na 0.9
EN=2.1
Cl 3.0
1s2
2s2
2p6
3s1
Na+
Cl-
1s2
2s2
2p6
3s2
3p5
Electronegatividad y porcentaje de carácter iónico
La relación entre las diferencias de la electronegatividad de dos átomos
en un enlace y el carácter de porcentaje iónico en el enlace, fue
deducida por Mailing originalmente, a partir de los datos de momentos
bipolares en haluros de hidrógeno. Pero el porcentaje de carácter
iónico, tambien puede obtenerse a partir de las diferencias de
electronegatividad.
a) Usando la ecuación de Pauling:
%CI = 100 [1-e-0,25
(Xa–Xb)2
]
Parael caso del HCl tenemos las electronegatividades respectivas para
cada elemento: (XH=2,1 ; XCl= 3,0)
%CI (HCl)= 100 [1-e-0,25
(3,0-2,1)2
]
= 100 (1,000 –0,834) = 16,6%
b) Usando la ecuación de Hannay y Smyth:
%CI = 16(Xa -Xb)+ 3,5 (Xa-Xb)2
Parael HCl, se tiene:
%CI = 16(3,0 –2,1) + 3,5(3,0 –2,1)2
= 16(0,9) + 3,5(0,9)2
= 14,4 + 2,83
= 17,2 %
Las escalas de electronegatividades y los momentos bipolares permiten
predecir el carácter polar más o menos marcado de un enlace
covalente. El cálculo del carácter iónico para sustancias iónicas es
inexacto, solo es útil paracompuestos covalentes polares.
116](https://image.slidesharecdn.com/clase3quimica-190601161206/85/Clase-3-quimica-64-320.jpg)





















![QUÍMICA GENERAL
11. ¿Qué afirmación es correcta?
a) ElAu es divalente
b) ElNH4OH es un hidróxido
c) Elcloruro de calcio es un oxisal
d) ElFeesnanovalente
e) ElSO3
-2
es el radical sulfito
12. Escriba la representación del radical sulfitoy bisulfito. Ejemplo.
13. Como obtiene el Cloruro de Plata. Explique mediante ecuaciones.
14. Explique mediante ecuaciones, la obtención de una sal de Cobre, a partir
del Acido Sulfúrico.
15. Mediante ecuaciones explique la obtención del dicromato de potasio.
16. Escriba la fórmula del ácido fosfórico y ácido ortofosfórico.
17. Indicarel nombre de los siguiente aniones
142
a) (SO2)-2
b) (NO2)-
c) MnO4
d)Fe [(CN)6]-3
e) (S2O5)-2
f) CO3
-2
18. De los siguientes compuestos binarios. ¿Cuáles tienen fuertecarácter
iónico?
a) NH3 b) NaBr c) BaCl2
19. Cuando el elemento estroncio, se combina con el elemento bromo, cada
átomo de estroncio:
A) gana electrones
B) pierde dos electrones
C) pierde un electrón E)no pierde ni gana
D) gana un electrón
20. Los átomos A, B, C y D están en el segundo periodo. Si tienen 1,3,5 y 7
electrones de valencia respectivamente. Hallar el tipo de enlace que
formanC con D.
21. Si tenemos los siguientes elementos X (Z=7), y E(Z=10). Al reaccionar
que tipo de enlace pueden formar.](https://image.slidesharecdn.com/clase3quimica-190601161206/85/Clase-3-quimica-90-320.jpg)










![QUÍMICA GENERAL
8. Elnúmero de átomos contenidos en un átomo-gramo de cualquier
elemento es:
a)
b)
c)
d)
e)
Variable con la presión
6,023 x 1023
6,023 x 1011
22,4 x 2024
22,4 x 1023
Solución:
De acuerdo a la definición del número de Avogadro
1 at–g contiene 6,023 x 1023
átomos
at.g
o también: NA = 6,023 x 1023 átomos
Respuesta:(b)
9. Calcular el peso molecular del K 3 [Fe(CN)6 ] . Utilizar las tablaspara los
pesos atómicos y ¿cuál es su composición centesimal?
Solución:
M K3[Fe(CN)6 ]
3K 3 x 39 = 117
1 Fe 1 x 55,85 = 55,85
6C
6N
6 x 12 = 72
6 x 14 = 84
M = 328,85vma
% K=
117
x 100 35,58
% Fe=
328,85
55,85
x 100 = 16,98
% C =
328,85
72
x 100 = 21,89
%N =
328,85
328,85
84
x 100 = 25,55
Respuesta: La composición es K=35,58%, Fe=16,98%, C=21,89% y
N=25,55%
10. Enel siguiente compuesto: CuSO4. 5H2O
a) Indicar la composición centesimal del oxígeno, hidrógeno, sodio y
azufre
b) Calcular el porcentaje en peso del agua
S= 32 H= 1
Solución:
a. Composición centesimal: CuSO4.5H2O
Cu= 63,5 O = 16
M CuSO4.5H2O= 249,5
153](https://image.slidesharecdn.com/clase3quimica-190601161206/85/Clase-3-quimica-101-320.jpg)








![QUÍMICA GENERAL
Reactantes Productos
24 Oxígenos 24 Oxígenos
MÉTODOS DE BALANCE DE ECUACIONES QUIMICAS
1. MÉTODO DELTANTEO:
O por simple inspección, se utiliza paraecuaciones sencillas y se
realiza por simple observación.
EJEMPLO
C6H6 + O2 CO2 + H2O
Enlos reactantes hay 6 carbonos, multiplicamos por 6 al
CO2(productos)
C6H6 + O2 6CO2 + H2O
Enlos reactantes hay 6 hidrógenos entonces multiplicamos por 3 a la
molécula del H2O obteniendo los 6 hidrógenos.
C6H6 + O2 6CO2 + 3H2O
Enel producto hay 15 oxígenos, entonces multiplicamos por 15/2 al
O2
C6H6 + 15/2O2 6CO2 + 3H2O
Paraevitar la fraccionalidad se multiplica por 2 toda la ecuación
química.
2C6H6 + 15O2 12CO2+ 6H2O
BALANCEAR POR TANTEO
a. FeCl3 + K4Fe(CN)6 Fe4[Fe(CN)6]3+ KCl
Productos: 18(CN), multiplicamos por 3 la molécula de
K4Fe(CN)6
FeCl3 + 3K4Fe(CN)6 Fe4[Fe(CN)6]3 + KCl
Enlos productos hay 7Fe y 12K en los reactantesmultiplicamos
por 4 al FeCl3 y por 12 al KCl.
4FeCl3 + 3K4Fe(CN)6 Fe4[Fe(CN)6]3 + 12KCl
162](https://image.slidesharecdn.com/clase3quimica-190601161206/85/Clase-3-quimica-110-320.jpg)

















































![QUÍMICA GENERAL
Entonces en la ecuación universal:
PV = (W/M )RT
W = (1) (22,4)(44)/[(0,082)(273)] W
= 44,03 g
Respuesta:La masa CO2 necesario es 44,03g
4. Una muestra de gas puro a 27°C y 380 mmHg ocupa un volumen de
492 mL¿Cuál es el número de moles de la muestra?
Solución:
De la ecuación universal:
n = PV /RT
n = 380 (0,492) /62,4 (300)
n = 9,9x10-3
mol -g
Respuesta: Las moles son 9,9x10-3
mol-g
5. 5,75 gramos de un gas ocupan un volumen de 3,4 La una temperatura
de 50°C y a una presión de 0,94 atm¿Cuál es su peso molecular?
Solución:
De la ecuación universal:
PV = (W/M )(RT)
M = WRT/(PV)
M = (5,75) (0,082)(323) /(0,94) (3,4)
M = 47,65 g/ mol
Respuesta: El peso molecular es 47,65 g/ mol
6. Se tiene una mezcla de gases de CO2 y CO en un recipiente cuyo
volumen es 17 litros, las moles de CO es la mitad de las de CO2, la
temperaturaes 27ºC y la presión parcial del CO es 7 atm.
a) Determinar la presión total
b) Determinar las moles de CO2 y CO
Solución
V= 171
212](https://image.slidesharecdn.com/clase3quimica-190601161206/85/Clase-3-quimica-160-320.jpg)


















































