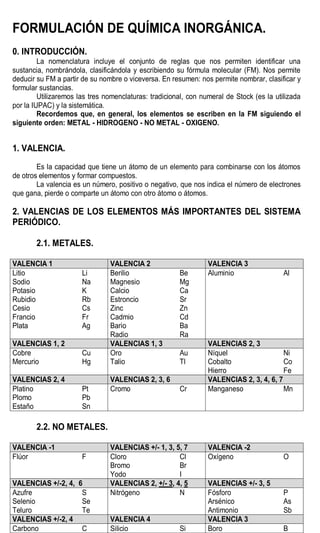
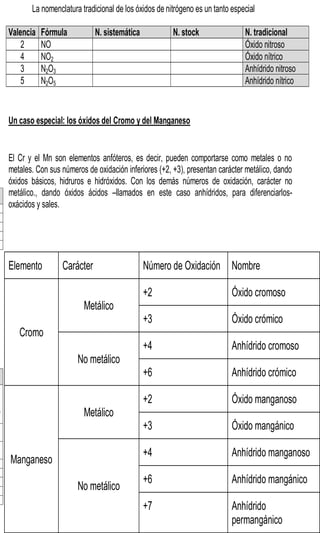
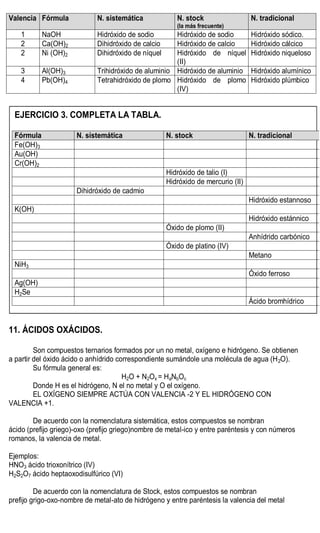
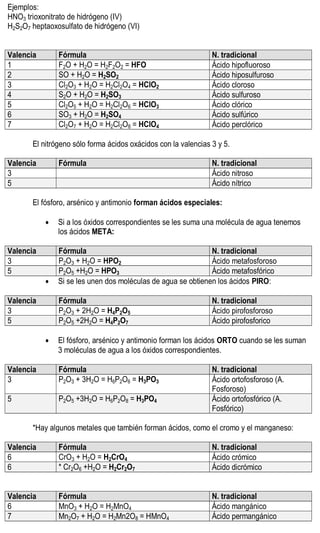
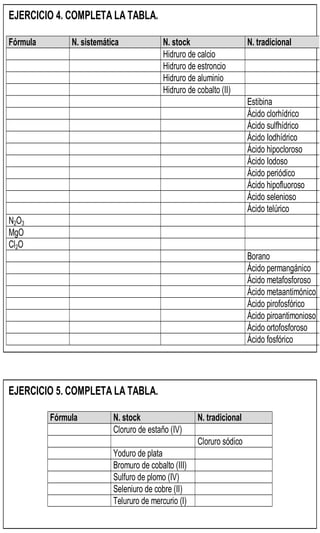
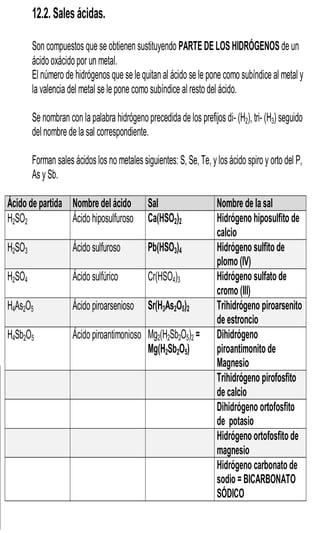
Este documento presenta información sobre la nomenclatura y formulación de compuestos inorgánicos. Introduce tres tipos de nomenclatura (sistemática, de Stock y tradicional) y explica conceptos como valencia y tipos de compuestos binarios como óxidos, hidruros metálicos y de no metales. También incluye tablas detallando las valencias de los elementos y ejemplos de cómo nombrar diversos compuestos inorgánicos según las diferentes nomenclaturas.