Teoria Cuantica
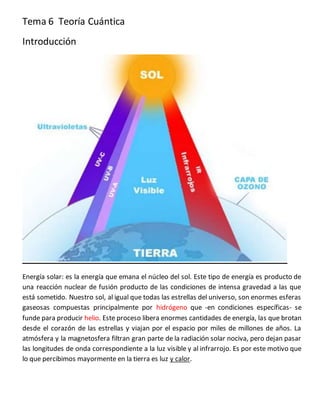
- 1. Tema 6 Teoría Cuántica Introducción Energía solar: es la energía que emana el núcleo del sol. Este tipo de energía es producto de una reacción nuclear de fusión producto de las condiciones de intensa gravedad a las que está sometido. Nuestro sol, al igual que todas las estrellas del universo, son enormes esferas gaseosas compuestas principalmente por hidrógeno que -en condiciones específicas- se funde para producir helio. Este proceso libera enormes cantidades de energía, las que brotan desde el corazón de las estrellas y viajan por el espacio por miles de millones de años. La atmósfera y la magnetosfera filtran gran parte de la radiación solar nociva, pero dejan pasar las longitudes de onda correspondiente a la luz visible y al infrarrojo. Es por este motivo que lo que percibimos mayormente en la tierra es luz y calor.
- 2. El planeta tierra se encuentra relativamente cerca del sol y su luz y energía tardan alrededor de 8 minutos en viajar esta distancia. El sol emite radiación en casi todo el espectro electromagnético. Llegan como ondas electromagnéticas. Esta energía ha sido y seguirá siendo el sostén para la vida y también la promotora de los más variados efectos sobre la superficie del planeta: entre otros, los vientos, la formación de nubes y lluvia o los cambios climáticos alrededor del globo. Entender el átomo y la energía es importante para cuidar nuestra salud y sobre todo aprender a aprovechar esa enorme fuente de energía. rayos X Ondas electromagnéticas muy penetrantes que atraviesan ciertos cuerpos opacos, originan impresiones fotográficas y se utilizan en medicina como medio de investigación y de tratamiento.
- 3. Fototerapia.- Las unidades de fototerapia son dispositivos que emiten luz, con longitud de onda entre 420 y 500 nm aproximadamente, para el tratamiento de la hiperbilirrubinemia, Laser.- depilación, desvanecimiento de arrugas, manchas, corneas, defectos de la vista Deportistas.- calambres, pérdida de elementos (sodio, potasio) ¡Los elementos químicos están en todas partes comprendámoslos un poco! Uno de los avances más importantes para la exploración del átomo fue la espectroscopia. Esta última es el estudio de los espectros y se basa en que cada elemento químico tiene su espectro característico (John Herschel), Bunsen y Kirchhoff describieron los espectros de numerosas sustancias y las consideraron como huellas dactilares, es así como gran parte de la información sobre la estructura del átomo se ha derivado de los estudios sobre espectros ópticos.
- 4. Espectros ópticos Estructura Atómica: Espectros de emisión. 6.1 TEORIA CUANTICA La teoría cuántica surgió para explicar por qué los cuerpos calientes emiten radiación electromagnética y forman espectros y condujeron a la necesidad de la introducción de concepto totalmente nuevos: el de cuanto o fotón y de la teoría cuántica. La teoría cuántica trata de explicar la relación dinámica entre las partículas subatómicas y la relación entre materia y radiación. Esta Teoría señala que los que los electrones sólo pueden encontrarse en ciertas orbitas con la posibilidad de determinar las que pueden ocupar y caracterizarlas por el número cuántico principal n. Teoría de Planck. En 1900 postuló que la materia solo puede emitir o absorber energía en pequeñas unidades discretas llamadas cuantos o fotones. De acuerdo con ella la energía no parece de forma continua,
- 5. sino como cuantos o fotones, cuya existencia explica los espectros atómicos como emisiones de energía por parte de los electrones que pasan de un nivel a otro. Los electrones solo pueden encontrarse en ciertas orbitas determinadas (número cuántico principal n) Modelo atómico de Bohr. a) Cada orbita o nivel de energía queda determinado por un número cuántico principal “n”. b) El nivel de menor energía es el más cercano al núcleo, los demás niveles siguen en orden creciente de energía. c) El número de niveles energéticos depende del número de electrones que tenga el átomo. d) Cada nivel energético se designa con números de 1 a 7 o letras como k, l, m, n, o, p, q. e) El electrón ni gana ni pierde energía mientras permanezca en su nivel. f) En el átomo, el electrón tiene su energía restringida a un nivel específico, si absorben o emiten energía (cuantos) saltan de un nivel a otro.
- 6. Los números cuánticos son parámetros o valores que satisfacen la ecuación de la mecánica cuántica. Se utilizan para describir la posición y la energía de los electrones inmersos en la nube electrónica que se encuentra rodeando el núcleo. Los números cuánticos son cuatro (4): 1.- Número cuántico principal (n) Cada orbita o nivel de energía queda determinado por un número cuántico principal “n”. Se refiere a la magnitud del volumen ocupado por el orbital en el cual se localiza el electrón diferencial se necesitan siete niveles de n=1 a n=7 a cada nivel energético
- 7. le corresponde un número de electrones que se deduce de la expresión 2n² en donde n es un número entero positivo q nos indica los niveles de energía. 2.-Numero cuántico azimutal ( l) Determina la forma de la región del espacio que ocupa un electrón. A este espacio se le llama subnivel u orbital (Establecido en 1916 para explicar estructura final que combina orbitas circulares y elípticas propuesto por Sommerfeld), después del segundo nivel hay subniveles que corresponden al número cuántico secundario; se representa por s, p, d, f. Tiene valores enteros desde 0, 1, 2 hasta (n-1) 3.- Número cuántico de momento magnético (Schrödinger), modelo plantea posibilidad de conocer posición y energía de un electrón) introduce tercer número cuántico al que llamo momento magnético m, permite calcular donde es probable que este el electrón. Su valor depende del valor de l, así m=2 l+1. 4.-Número cuántico de espín ( s), Dirac-Jordan estipularon que el electrón ya no describe orbita sino que genera nube electrónica. Cuarto número cuántico que equivale al giro o espín “s” del electrón sobre su propio eje, generando un campo eléctrico y solo puede tener dos direcciones: en sentido de las manecillas del reloj y viceversa. Los valores numéricos para este parámetro son +1/2 y -1/2 Nivel de energía (n) Número máximo de electrones 1 2 2 8 3 16
- 8. 4 32 6.2 CONFIGURACION ELECTRONICA El modelo atómico actual describe la distribución de los electrones en el átomo, en otras palabras, este modelo trata de explicar la estructura electrónica del átomo. La configuración electrónica es la forma en la que se acomodan los electrones dentro del átomo. Nos permite mostrar en forma grafica el numero de electrones que hay encada nivel y subnivel del atomo. Un nivel de energía n tiene n subniveles, los subniveles son s, p, d, f y tienen 1, 3, 5 y 7 orbitales respectivamente. Subnivel: es el grupo de orbitales de igual energía dentro de los niveles de energía principal. El número de subniveles en cada nivel de energía es el mismo que su número cuántico principal (n). Subnivel Número de electrones s 2 p 6 d 10 f 14
- 9. Nivel de energía principal n Número de subniveles Tipo de orbita Número de orbitales Número máximo de electrones por subnivel Número máximo total de electrones 1 1 s 1 2 2 2 2 2S 1 2 2p 3 6 8 3 3 3s 1 2 3p 3 6 3d 5 10 18 4 4 4s 1 2 4p 3 6 4d 5 10 4f 7 14 32 Los electrones que se ubican en los orbitales s: Los primeros dos electrones de cada nivel de energía se representan mediante un orbital s. Ejemplos: 1s, 2s, 3s, 4s, 5s, 6s, 7s. Los electrones que se ubican en los orbitales p: Es a partir del nivel segundo de energía, que hay un subnivel s y también un subnivel p. Cada subnivel p puede albergar hasta un máximo de 6 electrones. Los electrones que se ubican en los orbitales d y f: Es a partir del nivel 3 de energía que hay además un nivel d capaz de contener 5 pares de electrones, es decir, un total de máximo 10 electrones. En el nivel 4 de energía hay un subnivel f, capaz de alojar un máximo de 14 electrones. Cada elemento tiene una configuración electrónica propia, para escribirla se deben tomar en cuenta los siguientes aspectos:
- 10. Primero ¿Cuántos electrones hay que repartir? En un átomo eléctricamente neutro, este dato lo proporciona el número atómico (Z). Segundo El principio de edificación progresiva o regla de aufbau. Indica que los electrones se deben acomodar en orden creciente de su energía; o sea se llenan primero los de menor energía. Una manera sencilla de conocer la secuencia de llenado es el uso de la pirámide de aufbau o regla de las diagonales: La lectura de la configuración eléctronica de los elementos quimicoaw se realizas en la dirección de las flechas.
- 11. REGLA DE AUFBAU Tercero Principio de exclusión de Pauli: establece que en un orbital, como máximo, puede haber hasta 2 electrones con espin opuesto. Cuarto Principio de máxima multiplicidad o regla de Hund. Senala que en los casos donde existen varios orbitales disponibles del mismo tipo y no existen los electrones necesarios p[ara saturarlos se coloca un electron en cada orbital. Veamos un ejemplo, el del azufre (S): *El número atómico (Z) es 16: 16S *Forma condensada: 1s² 2s² 2p6 3s² 3p4
- 12. * Forma desarrollada: 1s² 2s² 2p²x 2p²y 2p²z 3s² 3p²x 3p1y 3p1z * Forma gráfica o vectorial: 1s 2s 2px 2py 2pz 3s 3px 3py 3pz Es muy importante que tomes en cuenta que las configuraciones electrónicas de los elementos se relacionan con su ubicación en la tabla periódica. En ella, los números atómicos están en orden creciente de energía de subnivel.
- 13. 1. Los elementos del bloque 1, los cuales incluyen el hidrógeno, el helio y todos los elementos contenidos en el grupo 1A y 2A; esta denominación simboliza que los 1 o 2 electrones finales en los elementos del bloque (s) se ubican en subniveles (s). El número de periodo indica el subnivel (s). 2. Los elementos del bloque (p), son los elementos que se encuentran en los grupos 3A al 8A. Hay seis elementos del bloque (p) en cada período porque cada subnivel (p) puede albergar hasta 6 electrones. 3. Los elementos del bloque (d) son los elementos llamados metales de transición. Hay 10 elementos en el bloque (d) porque pueden contener hasta 10 electrones. 4. Los elementos del bloque (f) incluyen todos los elementos en las dos filas finales de la tabla periódica. Hay 14 elementos en cada bloque (f) porque pueden contener hasta 14 electrones
- 14. 6.3 PRINCIPIO DE EXCLUSION DE PAULI, PRINCIPIO DE MAXIMA MULTICIPLICIDAD O REGLA DE HUND Y PRINCIPIO DE EDIFICACION PROGRESIVA O REGLA DE AUFBAU. TEMA 7 Tabla periodica
