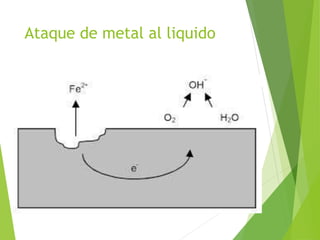
Este documento describe los diferentes tipos de corrosión, incluyendo la corrosión química, el ataque por metal líquido, la lixiviación selectiva, la disolución y oxidación de materiales cerámicos, y la corrosión galvánica. La corrosión ocurre a través de una reacción química entre una pieza manufacturada, el ambiente y el agua, formando pequeñas pilas galvánicas en la superficie expuesta del metal.