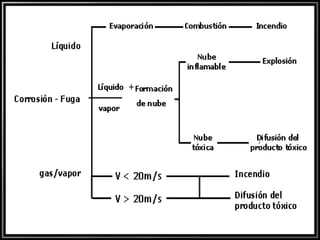
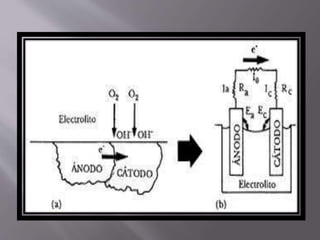
La corrosión es un deterioro de materiales causado por una reacción electroquímica con el entorno. Involucra tres factores: la pieza manufacturada, el ambiente y el agua. Existen varios tipos de corrosión como química, ataque de metal líquido y lixiviación selectiva. Los inhibidores de corrosión forman películas protectoras en las superficies metálicas.