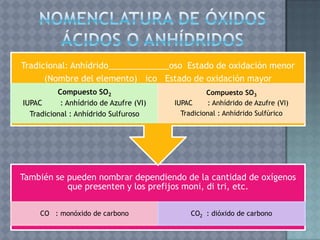
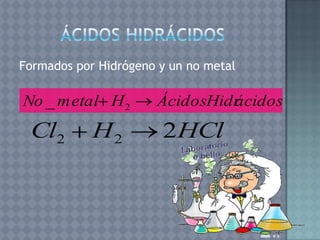
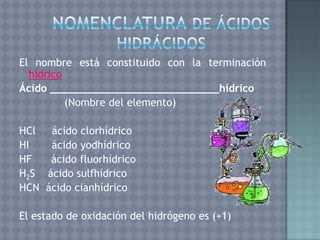
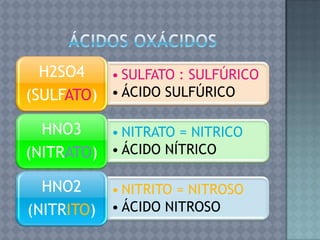
Este documento describe la formulación y nomenclatura de compuestos inorgánicos como óxidos, hidróxidos, anhídridos y ácidos. Explica que los óxidos se forman por la unión de un metal o no metal con oxígeno y cómo se clasifican. También explica la nomenclatura IUPAC para estos compuestos y cómo se derivan hidróxidos y ácidos a partir de óxidos.