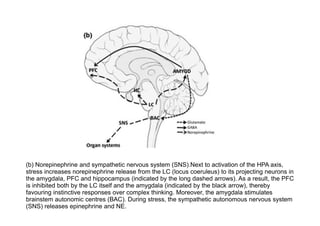
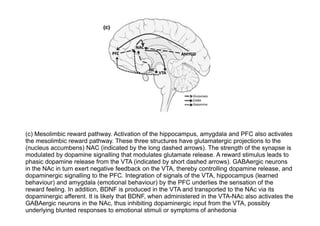
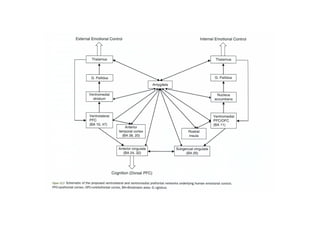
El documento resume la etiopatogenia de los trastornos del humor desde una perspectiva multifactorial. Explica que estos trastornos tienen factores genéticos, fisiopatológicos, psíquicos y sociales. Describe hallazgos de neuroimagen funcional y estructural que muestran anomalías en regiones como la amígdala, el córtex prefrontal y las conexiones entre estas áreas. También presenta evidencia de alteraciones neuroquímicas como aumentos de glutamato. El documento sugiere que algunas de estas anomalías pueden