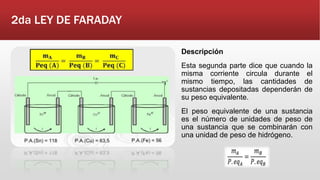
Este documento resume las leyes de Faraday de la electrolisis. Explica que Faraday descubrió que se podía inducir una corriente eléctrica en una bobina al acercar o alejar un imán. También define la electrolisis como la descomposición de un electrolito mediante una corriente eléctrica continua. Resume las dos leyes de Faraday, la ecuación de Nernst, y conceptos como ánodo, cátodo y fuerza electromotriz.