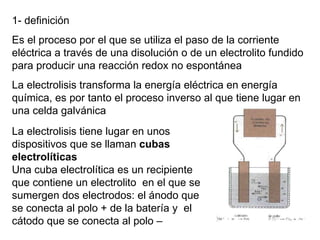
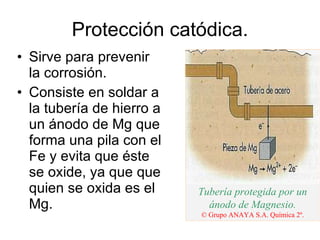
1) La electrolisis es el proceso por el que se utiliza la corriente eléctrica para producir una reacción química no espontánea mediante la transformación de energía eléctrica en energía química.
2) La electrolisis del agua requiere añadir ácido o hidróxido para aumentar la conductividad del agua.
3) La electrolisis del cloruro de sodio fundido descompone el compuesto en sodio metálico y cloro gaseoso aplicando un voltaje superior a 4,07 voltios