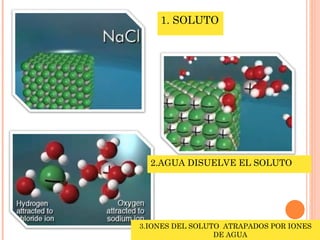
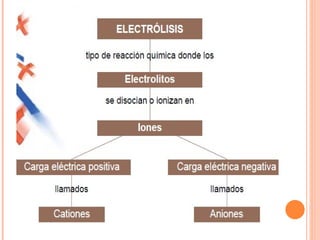
1. El documento define conceptos básicos de electroquímica como ionización, solución electrolítica, iones, electrolitos fuertes y débiles.
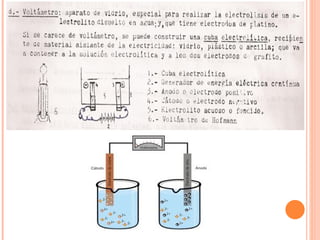
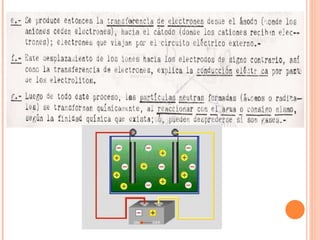
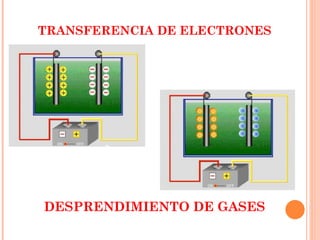
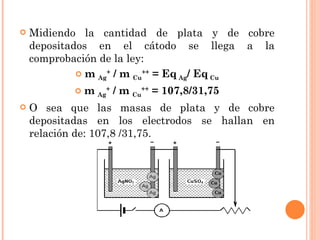
2. Explica cómo funciona la electrolisis y las leyes de Faraday sobre la cantidad de electrolito descompuesto en función de la corriente eléctrica y el tiempo.
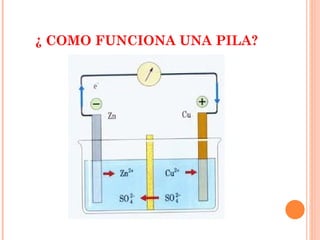
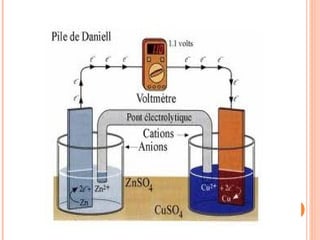
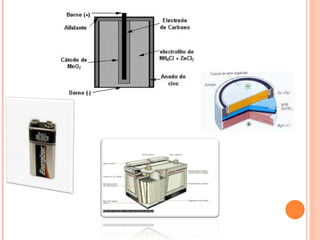
3. Describe diferentes modelos históricos de pilas como las de Volta, Daniell y Grove, e introduce conceptos como oxidación, reducción y despolarizador.