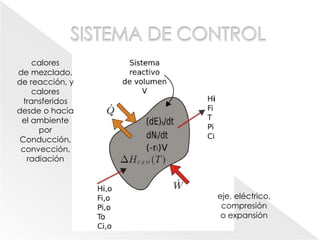
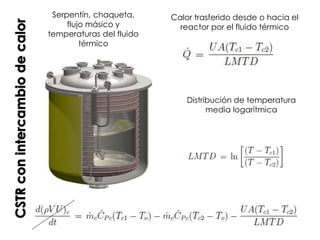
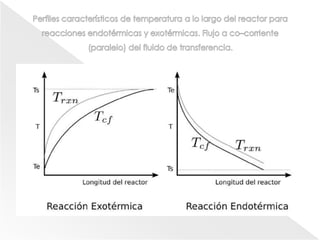
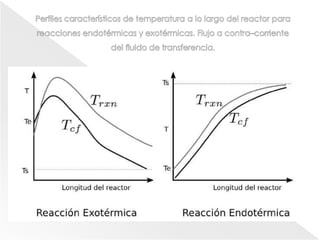
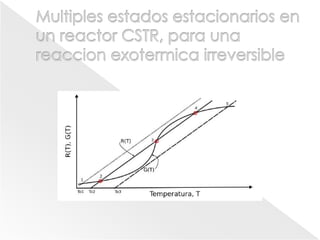
El documento describe los principios de la termodinámica y la cinética de reacciones químicas que ocurren en reactores. Explica que la energía acumulada en un sistema reactivo es igual a la energía de entrada menos la salida más la generada menos la consumida. También cubre temas como operaciones adiabáticas vs no adiabáticas, reacciones en equilibrio, cinética química y diseño de reactores CSTR y PFTR.