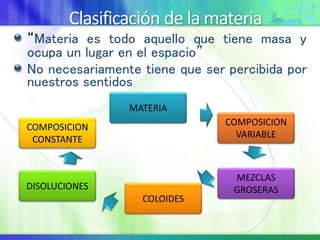
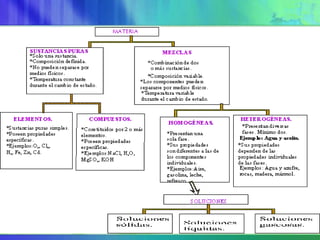
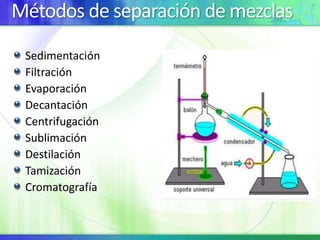
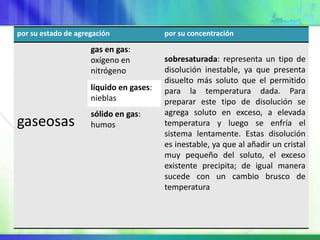
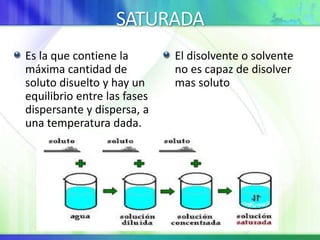
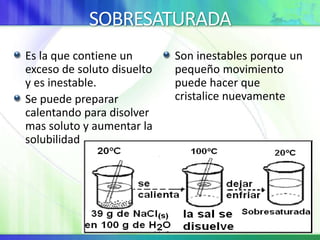
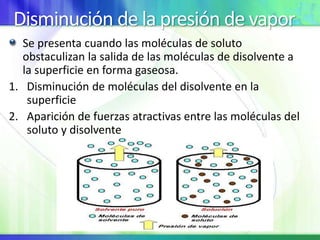
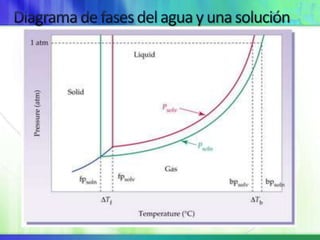
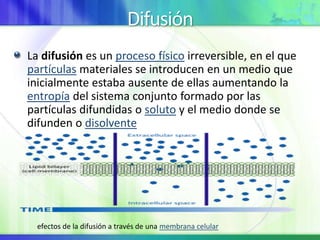
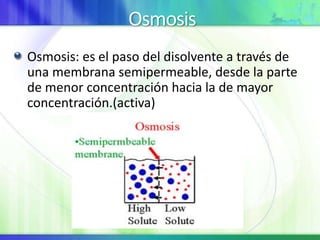
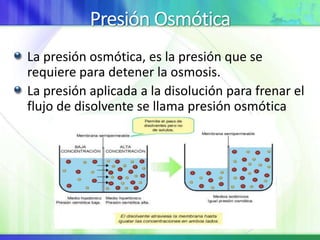
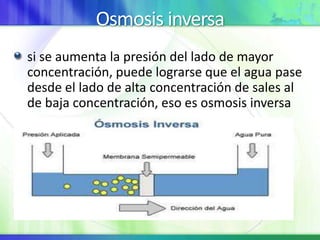
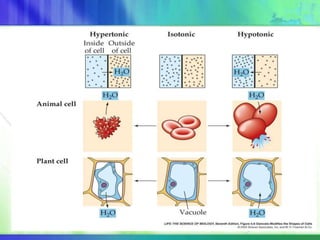
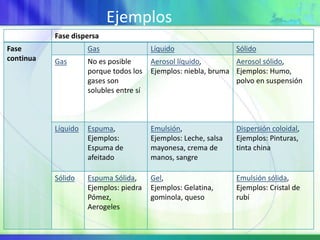
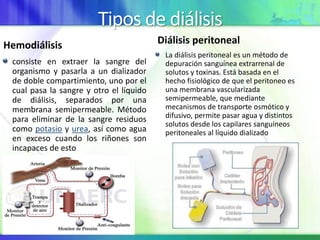
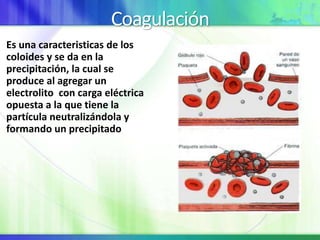
Este documento resume los conceptos fundamentales sobre la clasificación de la materia, las mezclas y las disoluciones. Explica que las mezclas se pueden clasificar en mezclas groseras, coloides y disoluciones, y describe las características de cada una. También define los componentes de las disoluciones, los estados y tipos de disoluciones, y los factores que afectan su velocidad. Por último, detalla algunas propiedades coligativas de las disoluciones como la disminución de la presión de vapor y el