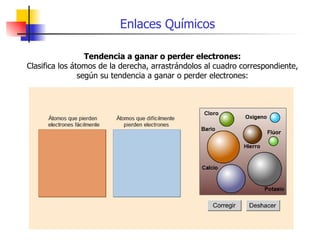
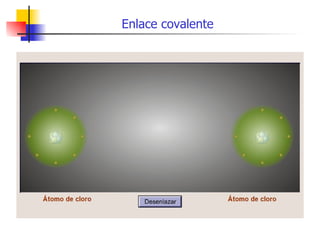
Este documento describe tres tipos principales de enlaces químicos: enlaces iónicos, enlaces covalentes y enlaces metálicos. Los enlaces iónicos involucran la transferencia de electrones entre átomos, los enlaces covalentes involucran el compartir de electrones entre átomos, y los enlaces metálicos involucran cationes positivos embebidos en una nube de electrones itinerantes.