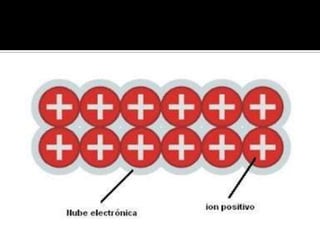
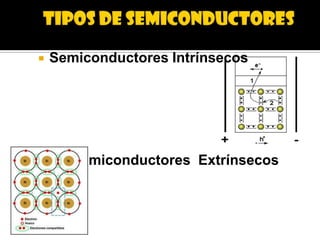
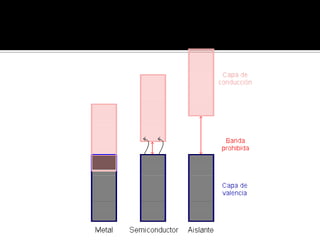
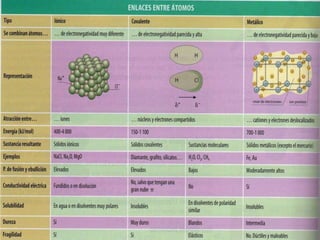
El documento describe el enlace metálico, explicando que los átomos metálicos comparten electrones de valencia para formar una "nube de electrones" que fluye libremente a través de la red metálica. Esto da como resultado propiedades como la alta conductividad eléctrica y térmica, la ductilidad y la maleabilidad de los metales. También distingue entre conductores, semiconductores y aislantes en función de su capacidad para conducir la corriente eléctrica.