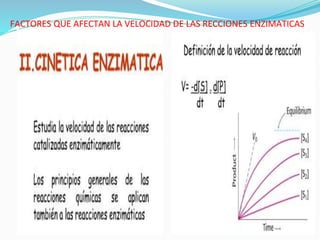
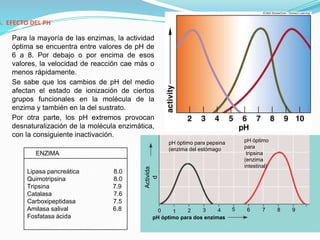
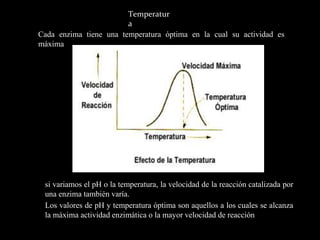
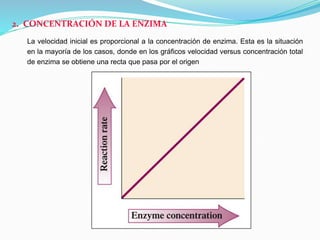
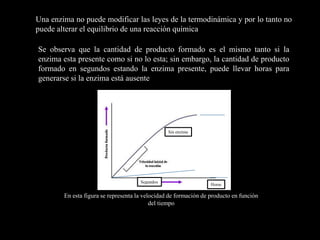
Las enzimas son catalizadores biológicos que aceleran las reacciones metabólicas sin modificarse a sí mismas. Son moléculas proteicas que exhiben alta especificidad para sustratos particulares y pueden catalizar reacciones a velocidades extremadamente rápidas. La actividad enzimática depende de factores como la concentración de sustrato, pH, temperatura e inhibidores.








![E +S ES
La unión es reversible y precisamente debido a esta reversibilidad , esta
primera etapa es la más lenta
2. Una vez formado el complejo enzima-sustrato, el cofactor, o los
aminoácidos del centro activo lleva a cabo la reacción y se obtiene el
producto final ( P) . Esta etapa es muy rápida e irreversible.
ES E + P
3. El producto se libera del centro activo y la apoenzima queda libre
para volver a unirse a nuevas moléculas de sustrato.
E + S [ ES] E + P](https://image.slidesharecdn.com/enzimas-220729172155-e6354593/85/Enzimas-pptx-12-320.jpg)