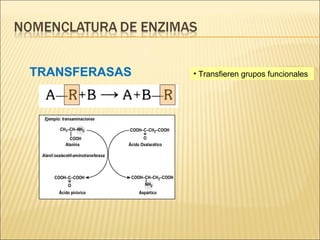
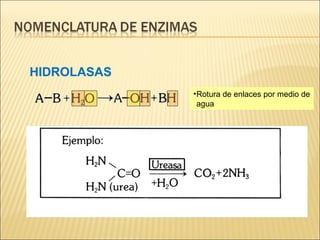
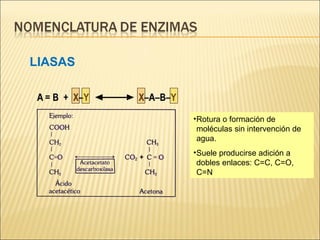
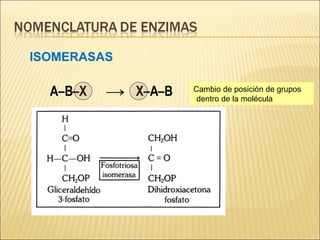
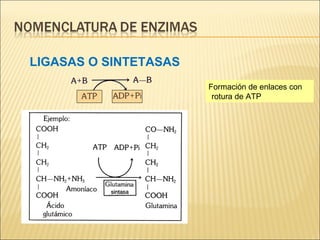
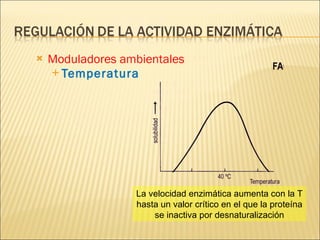
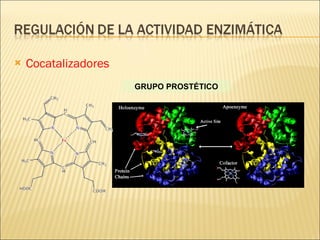
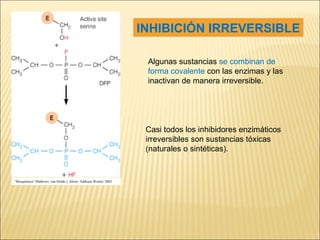
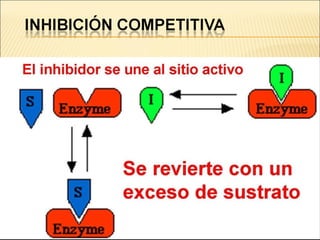
Las enzimas son catalizadores biológicos esenciales que aumentan la velocidad de las reacciones bioquímicas sin alterarse en el proceso, y su actividad depende de condiciones como pH, temperatura y concentración de sustrato. La especificidad enzimática hace que cada enzima actúe sobre un único tipo de sustrato, y su regulación se puede ver afectada por inhibidores que pueden ser reversibles o irreversibles. Existen diferentes clasificaciones de enzimas según su función y los cofactores o coenzimas que requieren para su actividad.









![VARIACIÓN DE LA [S]](https://image.slidesharecdn.com/enzimasyvitaminas-111126124034-phpapp02/85/Enzimas-y-vitaminas-12-320.jpg)
![ECUACIÓN DE MICHAELIS-MENTEN [S] V 0 = V max --------------- [S] + K M Cuando V = V max /2: K M = [S] Para [S] << K M : Vmax v ----------- [S] K M Para [S] >> K M : v Vmax k 2 [E 0 ] Concentración de sustrato, [S] Velocidad, V](https://image.slidesharecdn.com/enzimasyvitaminas-111126124034-phpapp02/85/Enzimas-y-vitaminas-13-320.jpg)
![Cuando: V o = V max Todos los sitios activos están ocupados y no hay moléculas de Enzima libre. K M = [S] Sí... ½ V max K M representa la cantidad de sustrato necesaria para fijarse a la mitad de la Enzima disponible y producir la mitad de la V max K M representa la concentración del sustrato en una célula](https://image.slidesharecdn.com/enzimasyvitaminas-111126124034-phpapp02/85/Enzimas-y-vitaminas-14-320.jpg)








![INHIBIDORES REVERSIBLES COMPETITIVOS Unión del Inhibidor al centro activo, el inhibidor compite con el S Aumenta K M No cambia V max “ Bioquímica” Mathews, van Holde y Ahern. Addison Wesley 2002 K ap = K M (1 + [I] / K I ) M [S] V 0 = V max --------------- [S] + K M ap](https://image.slidesharecdn.com/enzimasyvitaminas-111126124034-phpapp02/85/Enzimas-y-vitaminas-27-320.jpg)
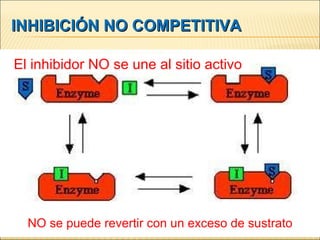
![INHIBIDORES REVERSIBLES NO COMPETITIVOS Unión del Inhibidor a un segundo lugar (no al centro activo), el inhibidor no compite con el S: No cambia K M Disminuye V max V ap = V max / (1 + [I] / K I ) Max “ Bioquímica” Mathews, van Holde y Ahern. Addison Wesley 2002 [S] V 0 = V max --------------- [S] + K M ap](https://image.slidesharecdn.com/enzimasyvitaminas-111126124034-phpapp02/85/Enzimas-y-vitaminas-29-320.jpg)




![- Presentan una cinética sigmoidal, indicativa de efectos cooperativos en la unión del sustrato. - Su actividad está regulada por otras moléculas efectoras. - Pueden mantener las concentraciones de sus sustratos en valores bastante constantes: * Existe una concentración crítica de sustrato ([S]c) por debajo de la cuál la enzima es prácticamente inactiva * Un pequeño aumento de la concentración de sustrato, por encima de la ([S]c, da lugar a un notable aumento de la actividad enzimática - Son proteínas con múltiples subunidades (múltiples centros activos y catalíticos) ENZIMAS ALOSTÉRICAS](https://image.slidesharecdn.com/enzimasyvitaminas-111126124034-phpapp02/85/Enzimas-y-vitaminas-37-320.jpg)