Incrustar presentación
Descargar para leer sin conexión

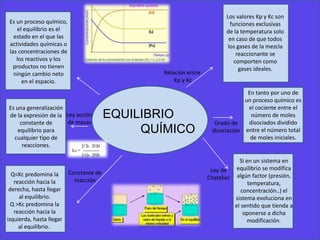
Este documento trata sobre el equilibrio químico. Explica que el equilibrio químico es el estado en el que las concentraciones de los reactivos y productos no cambian con el tiempo. También describe la ley de acción de masas, la constante de equilibrio y la ley de Le Chatelier, la cual establece que si se modifica un factor en un sistema en equilibrio, este evolucionará para oponerse a dicho cambio. Por último, define el grado de disociación y la relación entre las constantes de equilibrio Kp y

