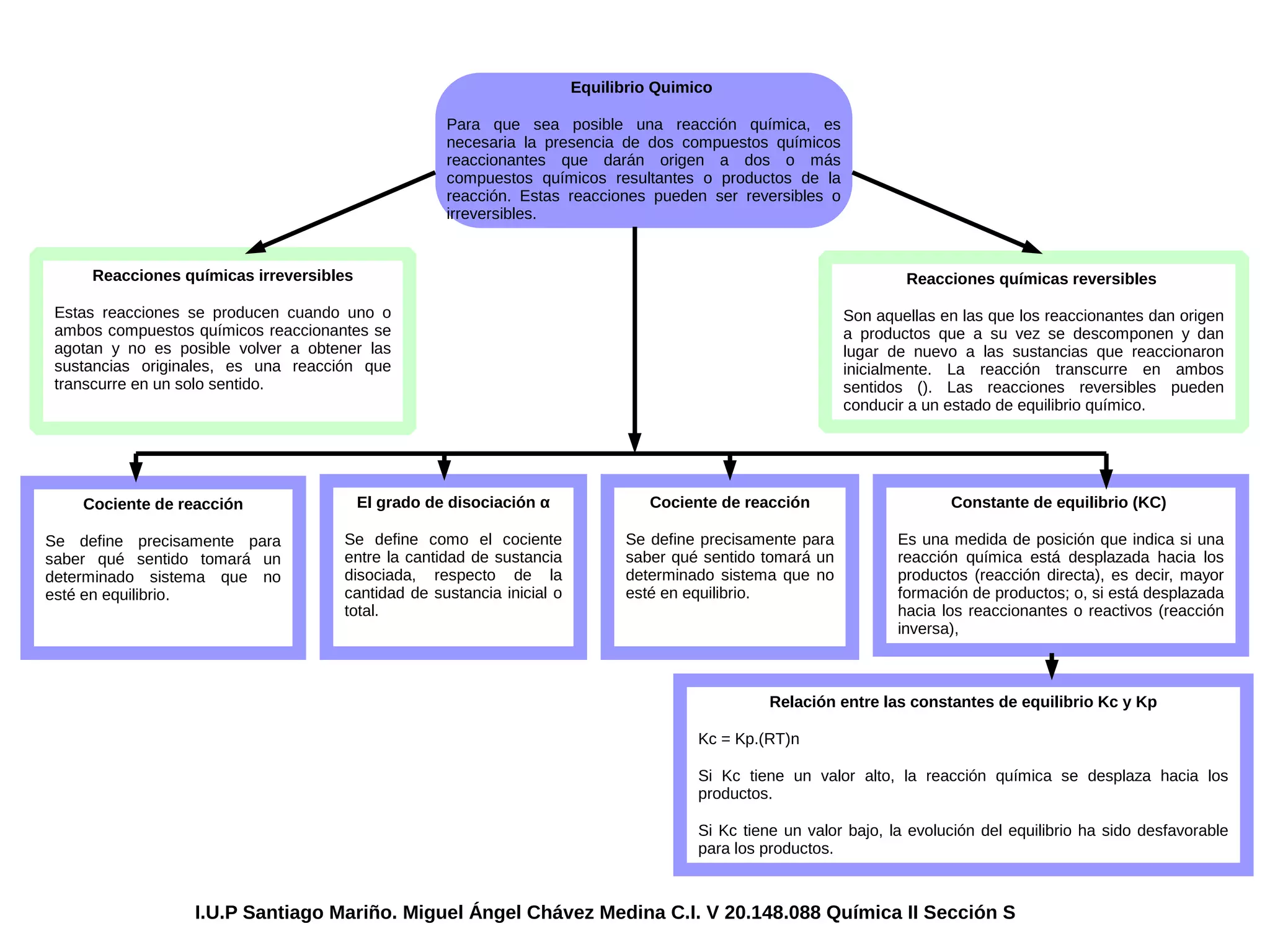
Este documento describe los conceptos básicos del equilibrio químico. Explica que las reacciones químicas pueden ser reversibles o irreversibles, y que las reacciones reversibles pueden alcanzar un estado de equilibrio. También define la constante de equilibrio como una medida de la posición del equilibrio, el grado de disociación, y la relación entre las constantes de equilibrio Kc y Kp.