El documento describe los conceptos fundamentales del equilibrio químico, incluyendo su definición como un estado dinámico en el que las concentraciones de las especies permanecen constantes, la ley de acción de masas y la constante de equilibrio, y cómo los sistemas en equilibrio responden a cambios en la concentración, temperatura y presión de acuerdo con el principio de Le Chatelier.


![Estudio cuantitativo del equilibrio
[R] y [P] = cte. inversadirecta vv =](https://image.slidesharecdn.com/equilibrioquimico-190628014315/85/Equilibrio-Quimico-3-320.jpg)
![Estudio cuantitativo …
[ ] [ ]ba
directadirecta BAKv =
[ ] [ ]dc
inversainversa DCKv =
[ ] [ ] [ ] [ ]dc
inversa
ba
directa DCKBAK =
a A(g) + b B(g) c C(g) + d D(g)
Vi
Vd
inversadirecta vv =
[ ] [ ]
[ ] [ ]
c
ba
dc
i
d
K
BA
DC
K
K
==](https://image.slidesharecdn.com/equilibrioquimico-190628014315/85/Equilibrio-Quimico-4-320.jpg)
![Ley de acción de masas
En una reacción química reversible en equilibrio
químico el cociente entre las concentraciones de los
productos y de los reactivos elevadas a sus respectivos
coeficientes estequiométricos es una cantidad
constante llamada: constante de equilibrio.
[ ] [ ]
[ ] [ ] ba
dc
c
BA
DC
K =](https://image.slidesharecdn.com/equilibrioquimico-190628014315/85/Equilibrio-Quimico-5-320.jpg)

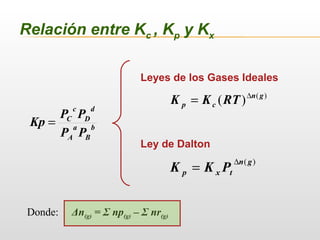
![a A(g) + b B(g) c C(g) + d D(g)
Vi
Vd
Distintas expresiones de Keq
b
B
a
A
d
D
c
C
PP
PP
Kp =
[ ] [ ]
[ ] [ ]ba
dc
BA
DC
Kc = b
B
a
A
d
D
c
C
XX
XX
Kx =
• Kc y Kp dependen solo de la T.
• Kx depende de T y P.
• Kc, Kp y Kx son adimensionales.](https://image.slidesharecdn.com/equilibrioquimico-190628014315/85/Equilibrio-Quimico-7-320.jpg)
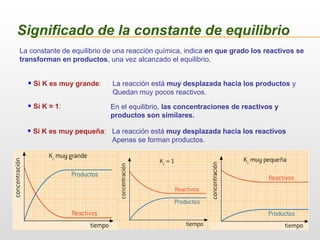
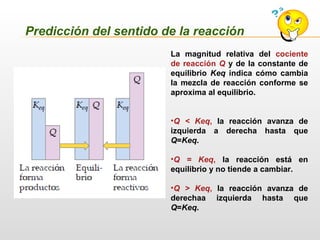
![Significado de la constante de equilibrio
[ ]
[ ]
r
p
eq
R
P
K =](https://image.slidesharecdn.com/equilibrioquimico-190628014315/85/Equilibrio-Quimico-10-320.jpg)
![Equilibrios homogéneos y heterogéneos
Un equilibrio HOMOGÉNEO presenta una sola fase;
Todos los reactivos y productos gaseosos integran la
Keq.
a A(g) + b B(g) c C(g) + d D(g)
b
B
a
A
d
D
c
C
PP
PP
Kp =
[ ] [ ]
[ ] [ ]ba
dc
BA
DC
Kc = b
B
a
A
d
D
c
C
XX
XX
Kx =](https://image.slidesharecdn.com/equilibrioquimico-190628014315/85/Equilibrio-Quimico-11-320.jpg)