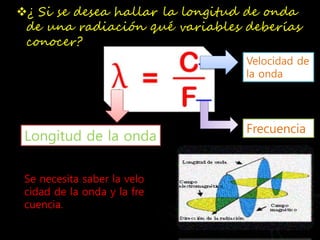
Este documento describe un experimento para identificar elementos químicos mediante la observación de los colores característicos que emiten al calentarse en una llama. Se explica que los electrones de los átomos solo pueden tener ciertos niveles de energía discretos, y al pasar de un nivel a otro emiten radiación de longitud de onda característica. El experimento involucra calentar muestras de sales de cloruro en una llama y observar los colores producidos, los cuales identifican los metales presentes como sodio, potas