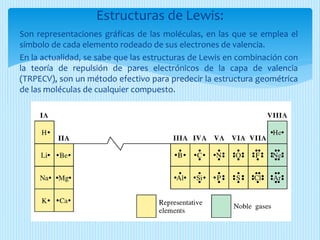
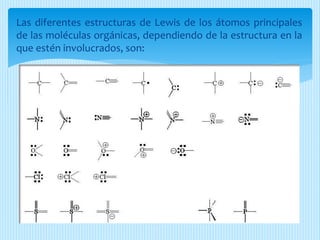
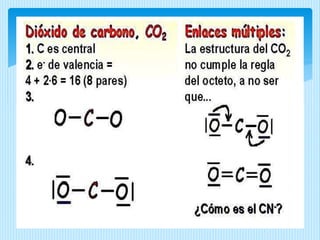
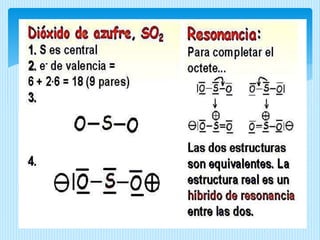
El documento describe la estructura de Lewis, propuesta por Gilbert Lewis en 1916 para representar la estructura molecular. La estructura de Lewis usa símbolos de elementos rodeados por electrones de valencia para mostrar enlaces químicos. El método predice con efectividad la geometría molecular al combinarse con la teoría de repulsión de pares electrónicos de la capa de valencia. A continuación, se detallan las reglas y pasos para construir estructuras de Lewis.