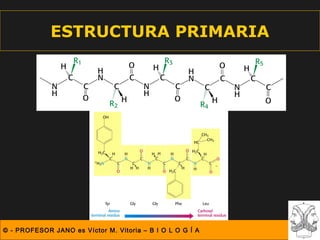
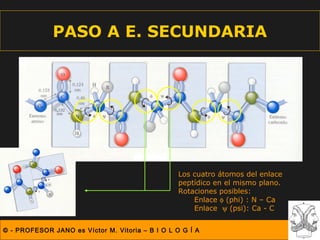
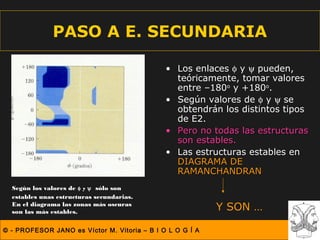
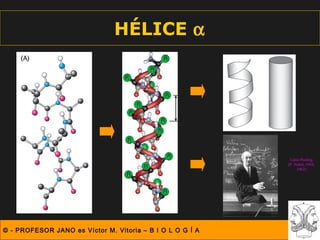
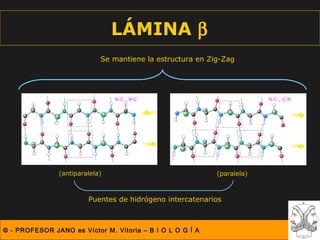
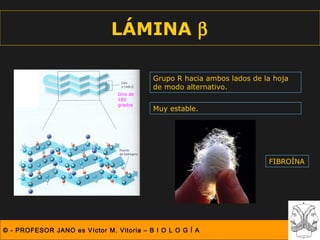
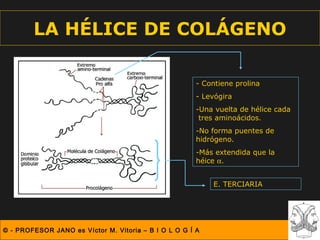
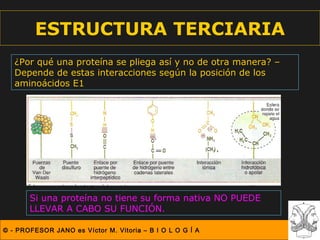
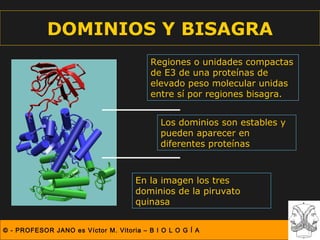
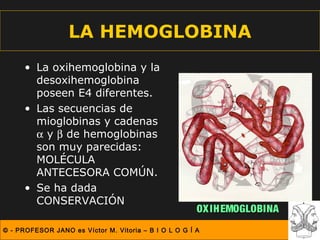
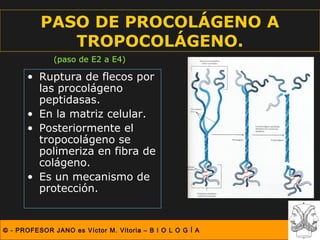
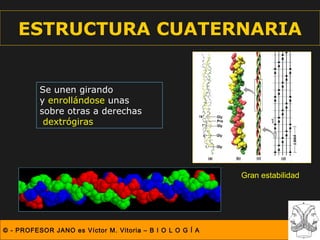
Este documento describe las diferentes estructuras de las proteínas, incluyendo la estructura primaria (secuencia de aminoácidos), secundaria (plegamientos como hélice alfa y lámina beta), terciaria (conformación tridimensional nativa), y cuaternaria (unión de subunidades proteicas). Explica cómo estas estructuras progresivas permiten a las proteínas adoptar formas funcionales específicas necesarias para llevar a cabo sus roles biológicos.