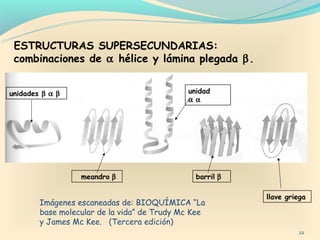
Este documento describe los diferentes niveles de organización estructural de las proteínas, incluyendo la estructura primaria, secundaria, terciaria y cuaternaria. También explica métodos para determinar las estructuras de proteínas como cristalografía de rayos X y resonancia magnética nuclear. Incluye ejemplos de estructuras secundarias como hélices alfa y hojas plegadas beta.