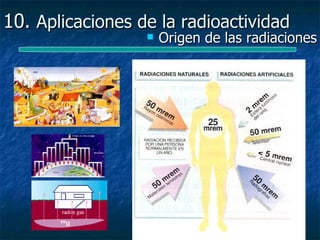
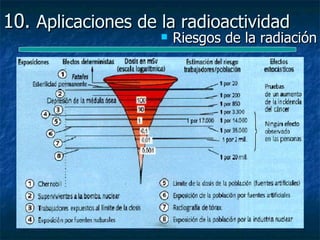
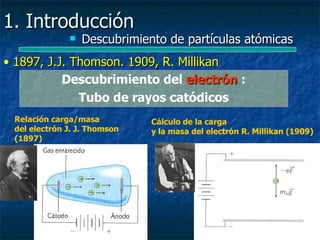
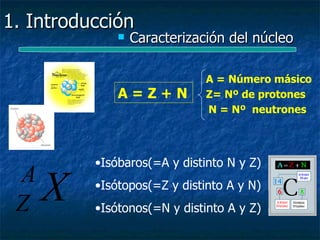
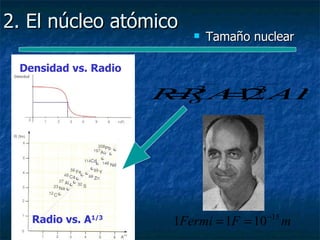
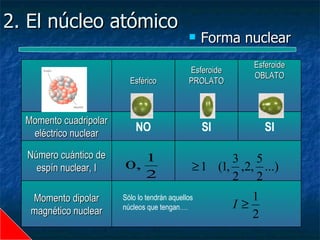
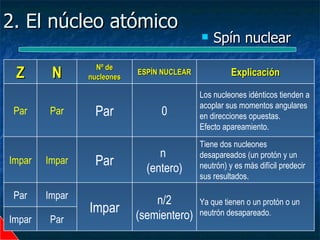
Este documento presenta una introducción a la física nuclear. Resume los principales descubrimientos que llevaron al entendimiento del átomo y sus componentes, incluyendo el electrón, protón, neutrón y núcleo atómico. También explica conceptos clave como la energía de enlace nuclear, las fuerzas nucleares fuertes y los modelos utilizados para describir la estructura del núcleo atómico.


































![6. Radioactividad natural
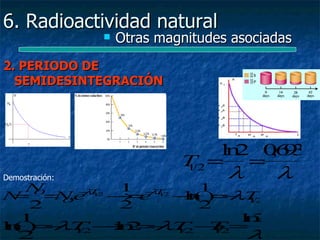
Ley de la desintegración radioactiva
4. Deducción de la LDR
−N
d El ritmo de desaparición de núcleos depende de: NÚCLEOS
=N λ
. PRESENTES, CONSTANTE DE DESINTEGRACIÓN
RADIOACTIVA
d t
−λ t
+N
d
N
=− t.λ
d N = N0 e
N t
N
∫ N =−∫ λdt
dN −λ t
=e
No t=0 NO
[ No= λ t=
l ] −[] 0
n N t
N t N
l N l N =n = λ
n −n O l
N
−t
O](https://image.slidesharecdn.com/fsicanuclearclase-120509061251-phpapp01/85/Fisica-nuclear-2-Bachillerato-52-320.jpg)