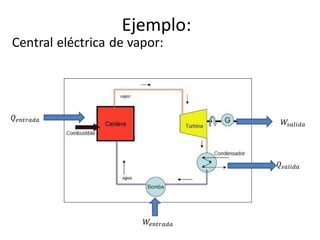
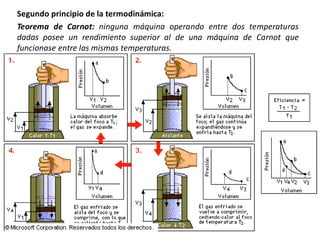
Una máquina térmica es un dispositivo que convierte calor en trabajo operando en un ciclo entre una fuente de calor y un sumidero. Funciona absorbiendo calor de una fuente a alta temperatura, convirtiendo parte de ese calor en trabajo, y descargando el calor restante a un sumidero a baja temperatura. La eficiencia de una máquina térmica se define como el trabajo neto producido dividido por el calor absorbido.