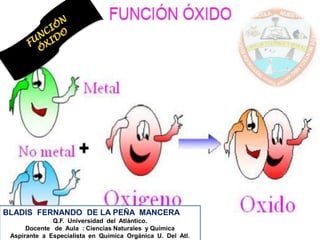
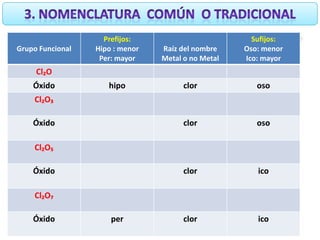
Este documento describe diferentes sistemas de nomenclatura para óxidos. Explica que los óxidos se forman cuando un metal u otro elemento se combina con oxígeno. Detalla que algunos elementos forman un solo óxido mientras que otros forman varios óxidos dependiendo de su número de oxidación. Además, compara la nomenclatura tradicional, la nomenclatura Stock y la nomenclatura sistemática para nombrar los diferentes óxidos.