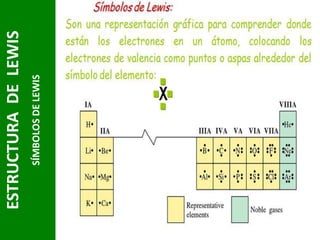
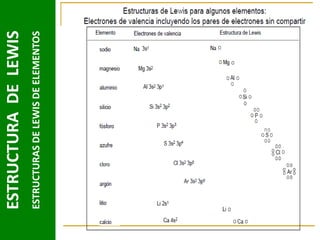
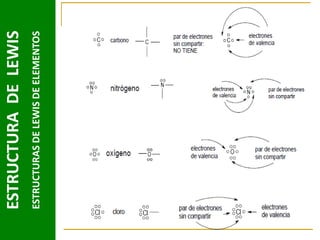
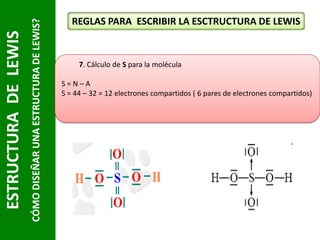
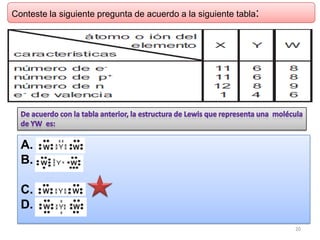
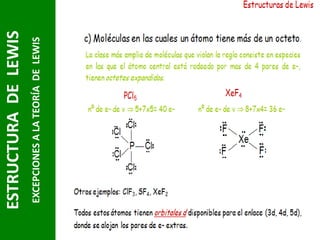
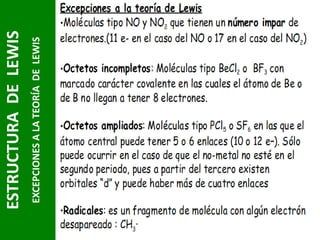
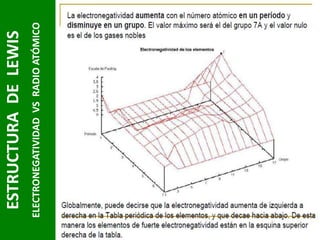
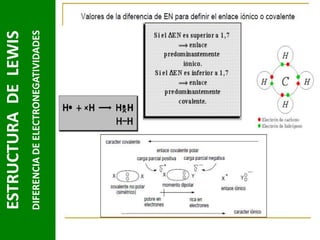
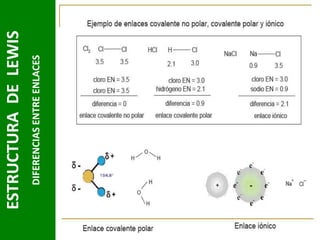
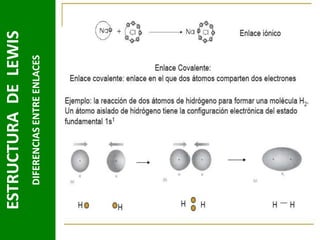
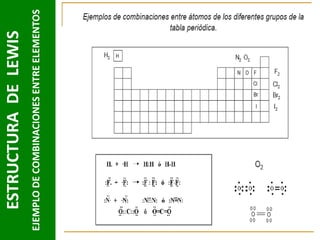
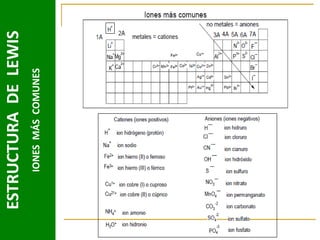
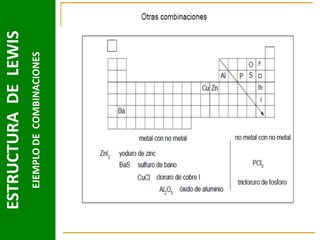
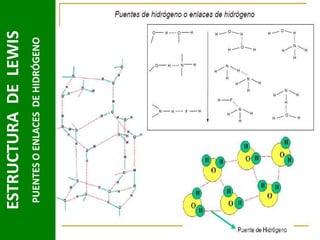
Este documento presenta una introducción a las estructuras de Lewis. Explica qué son las estructuras de Lewis, los símbolos utilizados y cómo diseñarlas siguiendo reglas como determinar el átomo central, calcular los electrones compartidos y distribuirlos para cumplir la regla del octeto. También cubre excepciones a la teoría de Lewis y conceptos como electronegatividad, tipos de enlaces, iones y números de oxidación. El objetivo es proporcionar una guía básica para representar enlaces químicos mediante e