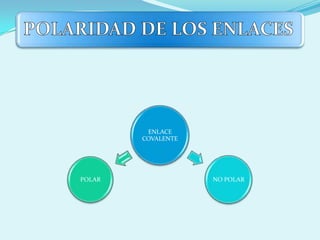
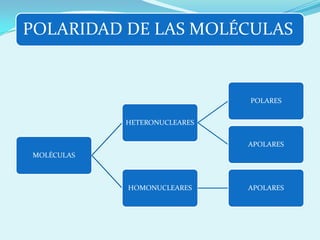
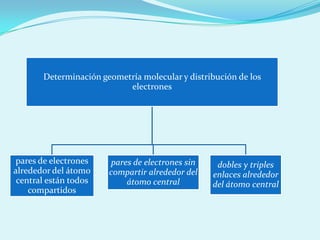
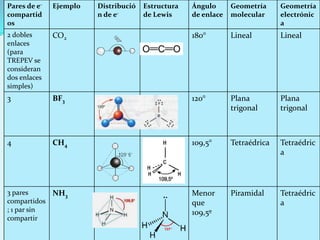
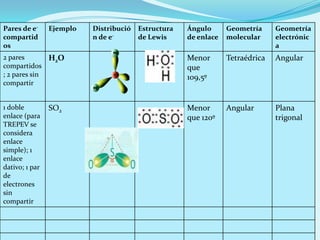
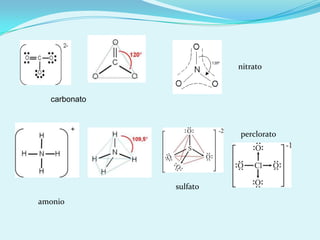
El documento describe la polaridad de los enlaces covalentes, destacando que los enlaces son apolares entre átomos iguales y polares entre átomos diferentes por la electronegatividad. Se explica cómo determinar la geometría molecular a través de la teoría de repulsión de pares de electrones de valencia y la diferencia entre geometría electrónica y molecular. Además, se ejemplifican diferentes geometrías moleculares y estructuras de iones.