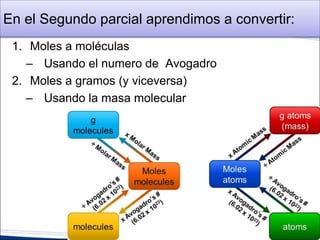
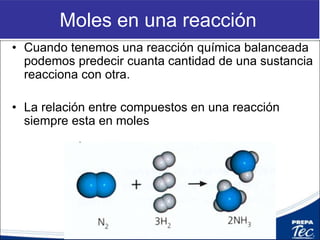
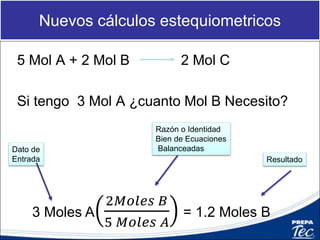
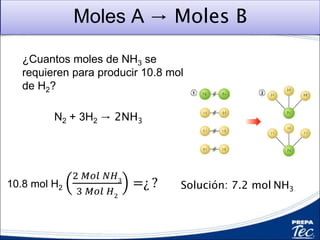
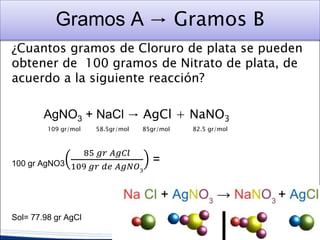
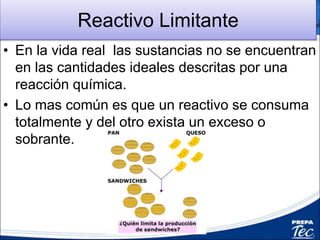
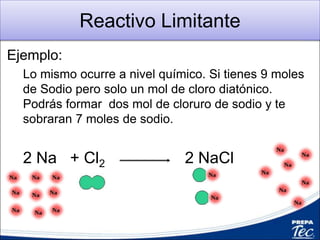
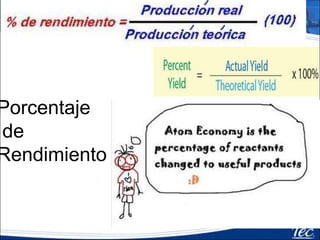
Este documento proporciona una introducción a la estequiometría, que incluye convertir entre moles y gramos, identificar el reactivo limitante, y calcular el rendimiento porcentual de una reacción. Explica cómo usar las relaciones estequiométricas entre los reactivos y productos para resolver problemas cuantitativos, como determinar la cantidad de uno que se necesita para producir una cantidad dada de otro.