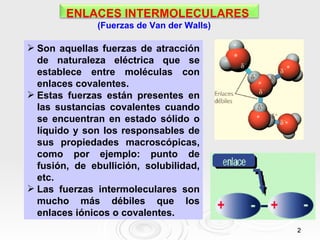
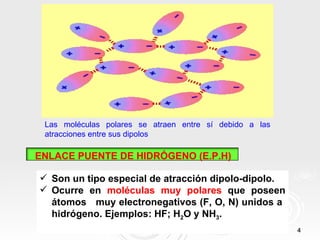
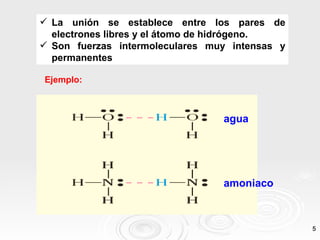
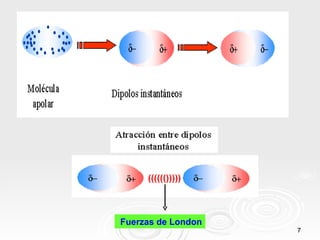
Este documento describe tres tipos principales de enlaces intermoleculares: 1) enlace dipolo-dipolo entre moléculas polares, 2) enlace de puente de hidrógeno entre moléculas que contienen átomos muy electronegativos unidos a hidrógeno, y 3) enlace mediante fuerzas de London entre moléculas apolares debido a la aparición de dipolos instantáneos.