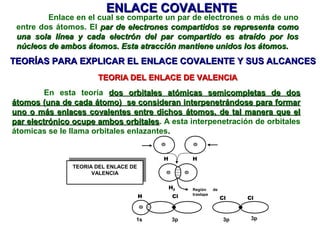
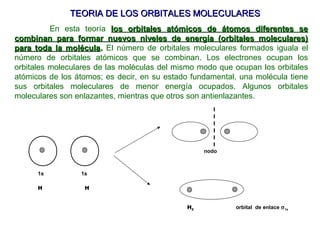
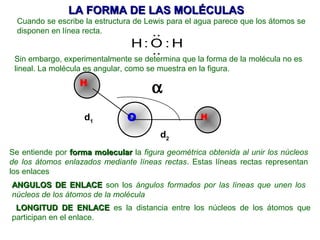
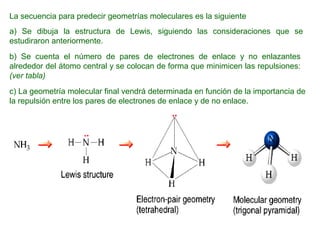
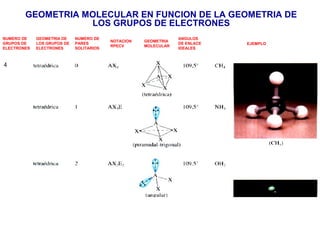
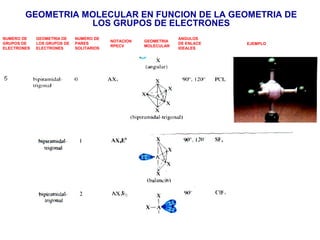
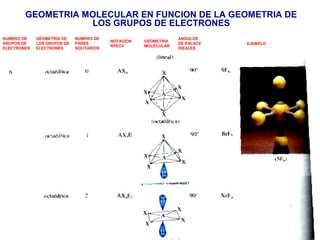
El documento explica las teorías del enlace covalente, incluyendo la teoría del enlace de valencia, la teoría de los orbitales moleculares y la polaridad de los enlaces. También describe cómo la geometría molecular de una sustancia depende del número de pares de electrones alrededor del átomo central según la teoría de la repulsión de pares de electrones de valencia.