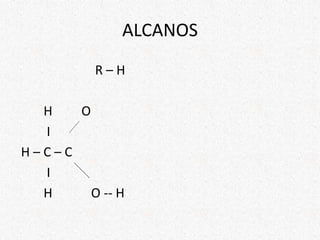
El documento proporciona información sobre diferentes grupos funcionales encontrados en compuestos de carbono, incluyendo alcanos, alquenos, alquinos, alcoholes, aldehídos y cetonas. Describe las propiedades químicas y físicas características de cada grupo, así como ejemplos de compuestos que los contienen.