Este documento presenta una guía temática para el examen de admisión del área de Ciencias Naturales y de la Salud de la Benemérita Universidad Autónoma de Puebla (BUAP) para el año 2015. Incluye una introducción sobre las carreras pertenecientes a este área y la descripción de la prueba de admisión. Además, proporciona un extenso temario con los contenidos que cubrirá el examen en las materias de Biología, Química, Física y Matemáticas. Finalmente, incl



























![7HRUtD GH ELRJpQHVLV )XH SURSXHVWD SRU 5HGGL TXLHQ D ILQDOHV GHO
VLJOR ;9,, KL]R XQ H[SHULPHQWR SDUD GHPRVWUDU OD IDOVHGDG GH OD
WHRUtD GH OD JHQHUDFLyQ HVSRQWiQHD /OHJy D OD FRQFOXVLyQ GH TXH OD
YLGD VyOR SXHGH RULJLQDUVH D SDUWLU GH OD YLGD
/D SXJQD HQWUH ODV WHRUtDV DQWHULRUHV JHQHUDFLyQ HVSRQWiQHD
ELRJpQHVLV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-28-320.jpg)



![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
UDGLDFLyQ XOWUDYLROHWD ORV UDRV FyVPLFRV ODV GHVFDUJDV HOpFWULFDV
DFWXDURQ VREUH ORV JDVHV GH OD DWPyVIHUD FUHDQGR PROpFXODV
RUJiQLFDV VHQFLOODV FRPSOHMDV DOJXQDV GH ODV FXDOHV VHUtDQ
LQHVWDEOHV VH GHVWUXLUtDQ PLHQWUDV TXH RWUDV FRPR DPLQRiFLGRV
D]~FDUHV iFLGRV JUDVRV DOFRKROHV DGHKtGRV WHUSHQRV RWURV VHUtDQ
HVWDEOHV SHUGXUDUtDQ HVWH KHFKR IXH GHPRVWUDGR SRU 0LOOHU 8UH
HQ HO ODERUDWRULR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-33-320.jpg)
![/DV PROpFXODV PiV SHVDGDV FDHQ SRU VX SHVR D ORV PDUHV
SULPLWLYRV GRQGH VXIUHQ OD SROLPHUL]DFLyQ FUHDQ SROtPHURV
SURWHtQDV iFLGRV QXFOHLFRV JO~FLGRV«](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-34-320.jpg)


![/D HYROXFLyQ GHO SURWRELRQWH RULJLQD OD SULPHUD FpOXOD TXH
UHDOL]D ODV WUHV IXQFLRQHV YLWDOHV GH QXWULFLyQ UHODFLyQ
UHSURGXFFLyQ (VWD FpOXOD VHUtD XQ SURFDULRWD KHWHUyWURIR DQDHURELR
TXH VH DOLPHQWDED GHO PHGLR
/D SREODFLyQ GHO SURFDULRWD DXPHQWy FRPHQ]y D HVFDVHDU HO
DOLPHQWR SURGXFLpQGRVH OD SULPHUD FULVLV HFROyJLFD $OJXQRV
DSUHQGHQ D DWDFDU D VXV VHPHMDQWHV DSDUHFLHQGR DVt ORV FDUQtYRURV
SHUR HO DOLPHQWR VHJXtD HVFDVHDQGR DOJXQRV GH HVWRV DSUHQGLHURQ D
XVDU OD OX] PHGLDQWH OD FORURILOD FUHiQGRVH DVt ORV SULPHURV
SURFDULRWDV DXWyWURIDV TXH SURGXFtDQ PDWHULD RUJiQLFD D SDUWLU GH
PDWHULD LQRUJiQLFD SHUR TXH HOLPLQDEDQ R[tJHQR FRPR SURGXFWR
UHVLGXDO HO FXDO DO DFXPXODUVH HQ OD DWPyVIHUD WUDQVIRUPy OD
DWPyVIHUD UHGXFWRUD HQ R[LGDQWH SURGXFLpQGRVH DVt OD VHJXQGD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-37-320.jpg)




![7(25Ì$6 62%5( /$ (92/8,Ð1
7LHQHQ SRU REMHWR HO HVWXGLR GH ODV FDXVDV GH ORV FDPELRV WHPSRUDOHV
GH ORV RUJDQLVPRV HV GHFLU LQWHQWDQ H[SOLFDU
x /D HVSHFLDFLyQ
x /D FUHDFLyQ GH QXHYRV WLSRV GH RUJDQL]DFLyQ
x /D DSDULFLyQ GH DGDSWDFLRQHV
/DV SULQFLSDOHV WHRUtDV HYROXWLYDV VH FODVLILFDQ HQ
)LMLVWDV
6RQ ODV TXH LQGLFDQ TXH ODV HVSHFLHV VRQ LQPXWDEOHV GHVGH VX FUHDFLyQ
HV GHFLU VRQ FUHDFLRQLVWDV )XH GHIHQGLGD SRU /LQQHR XYLHU TXLHQ LQGLFy
TXH ODV HVSHFLHV SRVHHQ LQGLYLGXRV TXH SURFHGHQ XQRV GH RWURV HV GHFLU TXH
VH SDUHFHQ D VXV SDGUHV XYLHU SRVWXOy OD WHRUtD GH ODV FUHDFLRQHV
VXFHVLYDV LQWHUFDODGDV FRQ OD LQFLGHQFLD GH FDWDFOLVPRV TXH GHVWUXHQ WRGD
OD YLGD SUHH[LVWHQWH SRU OR TXH 'LRV FUHD RWURV VHUHV YLYRV QXHYRV WDPELpQ
VH OODPDQ FDWDVWURILVWDV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-42-320.jpg)

![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
KDQ REOLJDGR D OD IRUPDFLyQ GH QXHYDV HVSHFLHV D OD DSDULFLyQ GH QXHYRV
WLSRV GH RUJDQL]DFLyQ 3DUD H[SOLFDU ODV FDXVDV TXH SURYRFDQ HO FDPELR VH
KDQ GDGR GLYHUVDV WHRUtDV
/DPDUFNLVPR
)XH GDGD SRU /DPDUFN SDUD pO HO PRWRU GH OD HYROXFLyQ HV OD
DGDSWDFLyQ DO PHGLR 6XSRQH TXH WRGRV ORV RUJDQLVPRV WLHQGHQ D XQD
PDRU FRPSOHMLGDG HVWUXFWXUDO VXSRQH
D 8QD HVSHFLH SURFHGH GH RWUD SRU FDPELR HQ OD SULPHUD
E (V HO PHGLR OD FDXVD GHO FDPELR HQ OD HVSHFLH SULPHUD TXH KDFH
DSDUHFHU FDUDFWHUHV TXH QR HVWDEDQ DQWHV FDUiFWHU DGTXLULGR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-44-320.jpg)

![7HRUtD GH OD VHOHFFLyQ QDWXUDO
)XH GDGD SRU 'DUZLQ :DOODFH GH IRUPD LQGHSHQGLHQWH SDUD HOORV
OD FDXVD R PRWRU GH OD HYROXFLyQ HV OD VHOHFFLyQ QDWXUDO 6XSRQH
D /XFKD SRU OD H[LVWHQFLD (V GHFLU HQ OD SREODFLyQ VH SURGXFHQ
PiV LQGLYLGXRV TXH ORV TXH HO PHGLR SXHGH VRSRUWDU SHUR VH
PDQWLHQH HVWH Q~PHUR GH LQGLYLGXRV SRUTXH OD PDRUtD GH HOORV
PXHUHQ DQWHV GH DOFDQ]DU OD FDSDFLGDG UHSURGXFWRUD DO QR
FRQVHJXLU DOLPHQWR
E 9DULDELOLGDG LQWUDHVSHFtILFD +D YDULDFLRQHV LQGLYLGXDOHV HQWUH
ORV LQGLYLGXRV GH XQD PLVPD HVSHFLD TXH KDFHQ TXH DOJXQRV GH HOORV
HVWpQ PHMRU DGDSWDGRV DO PHGLR TXH RWURV /RV PHMRU DGDSWDGRV
FRQVHJXLUiQ PHMRU HO DOLPHQWR SRGUiQ DFFHGHU D OD UHSURGXFFLyQ
GHMDQGR GHVFHQGHQFLD PLHQWUDV TXH ORV SHRU DGDSWDGRV R PXHUHQ
DQWHV GH DOFDQ]DU OD PDGXUH] VH[XDO R VL OD DOFDQ]DQ QR WLHQHQ
DFFHVR D OD UHSURGXFFLyQ SRU OR TXH VXV JHQHV GHVDSDUHFHQ GH OD
SREODFLyQ (V GHFLU HO SURFHVR HYROXWLYR HV JUDGXDO FRQWLQXR
F 6HOHFFLyQ QDWXUDO (V GHFLU HV HO PHGLR DPELHQWH TXLHQ VHOHFFLRQD
D ORV LQGLYLGXRV TXH HVWiQ PHMRU DGDSWDGRV D pO HV GHFLU
VHOHFFLRQD ORV FDUDFWHUHV PiV EHQHILFLRVRV ORV JHQHV GH ORV TXH
GHSHQGHQ HVWRV FDUDFWHUHV HQ GHWULPHQWR GH ORV QR VHOHFFLRQDGRV
/D VHOHFFLyQ QDWXUDO DFXPXOD HVWRV FDPELRV ORV JHQHV
UHVSRQVDEOHV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-46-320.jpg)



![0HFDQLVPRV GH OD HYROXFLyQ /D YDULDELOLGDG JHQpWLFD HQ OD
SREODFLyQ VH FRQVLJXH SRU PXWDFLyQ UHFRPELQDFLyQ
UHRUJDQL]DFLyQ GH ODV PXWDFLRQHV DFXPXODGDV GXUDQWH HO SURFHVR
GH PHLRVLV /D JUDQ GLYHUVLGDG JHQpWLFD FUHDGD GD D OD SREODFLyQ OD
SRVLELOLGDG GH XQD JUDQ DGDSWDELOLGDG D XQ PHGLR DPELHQWH
FDPELDQWH SRU OR WDQWR OH GD PDRU SUREDELOLGDG GH VREUHYLYLU](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-50-320.jpg)


![$LVODPLHQWR UHSURGXFWLYR FRPR UHVSRQVDEOH GH OD IRUPDFLyQ GH
QXHYDV HVSHFLHV R HVSHFLDFLyQ
'HILQH OD SREODFLyQ FRPR FRQMXQWR GH LQGLYLGXRV VHPHMDQWHV HQWUH Vt
FRQ JHQHV FRPXQHV FDSDFHV GH UHSURGXFLUVH HQWUH HOORV GDU XQD
GHVFHQGHQFLD IpUWLO
7HRUtD GHO HTXLOLEULR SXQWXDGR GH (OGUHGJH R VDOWDFLRQLVWD
6XSRQH TXH D YHFHV OD HYROXFLyQ VH SURGXFH D VDOWRV SRU DFXPXOR GH
PXWDFLRQHV SXQWXDOHV TXH VH PDQLILHVWDQ GH JROSH DO HQFRQWUDUVH FRQ XQ
PHGLR DPELHQWH IDYRUDEOH D HOODV
7HRUtD QHXWUDOLVWD GH .LPXUD
6XSRQH TXH OD PXWDFLyQ SXHGH SURGXFLU JHQHV QHXWURV SDUD XQD
GHWHUPLQDGD SREODFLyQ TXH QR LQIOXHQ HQ OD VXSHUYLYHQFLD GH OD HVSHFLH
SHUR TXH DO WUDQVPLWLUVH SXHGHQ PDQLIHVWDUVH KDFLHQGR TXH DSDUH]FDQ
QXHYDV HVSHFLHV
0($1,6026 '( (92/8,Ð1
/DV FDUDFWHUtVWLFDV PDQLIHVWDGDV SRU XQ LQGLYLGXR H LQFOXVR VX
FRPSRUWDPLHQWR GHSHQGHQ GH OD VHFXHQFLD GH DPLQRiFLGRV GH VXV SURWHtQDV
HQ ~OWLPR WpUPLQR GH OD VHFXHQFLD GH QXFOHyWLGRV HQ VXV iFLGRV QXFOHLFRV
HV GHFLU GH OD VHFXHQFLD GH EDVHV GH ORV JHQHV SRU HOOR OD HYROXFLyQ VLHPSUH
FRQOOHYD XQ FDPELR HQ HVWD LQIRUPDFLyQ DOPDFHQDGD HQ ORV iFLGRV QXFOHLFRV
JHQ JHQ
$'1
Ļ Ļ
SURWHtQD SURWHtQD
Ļ HYROXFLyQ
JHQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-53-320.jpg)






![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
Q~PHUR GH GLIHUHQFLDV HQWUH VXV $'1 GH PRGR TXH FXDQWD PiV
GLIHUHQFLD KDD PDRU YD D VHU VX VHSDUDFLyQ HQ OD HYROXFLyQ
E 0XWDFLRQHV UHJXODGRUDV TXH DIHFWDQ D ODV SURWHtQDV TXH UHJXODQ OD
H[SUHVLyQ GH ORV JHQHV HVWUXFWXUDOHV (VWH HV HO PHFDQLVPR TXH
UHJXOD OD IRWRPRUIRJpQHVLV HV GHFLU OD OX] DFWLYD D JHQHV YHJHWDOHV
FRQWURODQGR HO FUHFLPLHQWR GH OD SODQWD OD IORUDFLyQ HO Q~PHUR GH
KRMDV«
F 9DULDELOLGDG JHQpWLFD 3RU YDULDELOLGDG HQWHQGHPRV HO Q~PHUR GH
DOHORV GLIHUHQWHV TXH SUHVHQWD XQD SREODFLyQ SDUD XQ GHWHUPLQDGR
FDUiFWHU /D YDULDELOLGDG DOWD HQ XQD SREODFLyQ GHWHUPLQD VX HYROXFLyQ
D TXH HQ ORV GLVWLQWRV DPELHQWHV VH SRWHQFLDUi XQR GH HOORV HQ
GHWULPHQWR GH ORV RWURV KDFLHQGR TXH DSDUH]FDQ GLYHUVDV UD]DV R
HVSHFLHV FRQ HO SDVR GH ORV DxRV 3RU HOORV OD UHSURGXFFLyQ VH[XDO
IXHQWH GH JUDQ YDULDELOLGDG](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-60-320.jpg)
![HV PX LPSRUWDQWH FRPR PHFDQLVPR GH
HYROXFLyQ DO SURGXFLUVH HQ HOOD OD UHFRPELQDFLyQ JHQpWLFD
G $GDSWDFLyQ (V RWUR PHFDQLVPR TXH IDYRUHFH OD HYROXFLyQ SRUTXH XQ
RUJDQLVPR VH DGDSWDUi PHMRU D XQ DPELHQWH FXDQWD PiV YDULDELOLGDG
KDD HQ HVH DPELHQWH +D FDUDFWHUHV QR DGDSWDWLYRV TXH HYROXFLRQDQ
DO PLVPR WLHPSR TXH XQ FDUiFWHU DGDSWDWLYR SURGXFLpQGRVH OD
FRHYROXFLyQ R DGDSWDFLyQ GH GRV RUJDQLVPRV TXH FRPSOHPHQWDQ VX
VXSHUYLYHQFLD ODV IORUHV HYROXFLRQDQ HQ VX PRUIRORJtD GHSHQGLHQGR
GHO DJHQWH SROLQL]DGRU](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-61-320.jpg)
![H (YROXFLyQ ILOpWLFD $QWH XQ PHGLR DPELHQWH FDPELDQWH HO VHU YLYR
SURGXFH FDPELRV HQ VXV GHVFHQGLHQWHV SDUD TXH VH DGDSWHQ
SDXODWLQDPHQWH DO PLVPR RULJLQiQGRVH DVt QXHYDV HVSHFLHV VLQ
DXPHQWDU HO Q~PHUR GH HOODV 7DO KHFKR RFXUULy FRQ ORV PDVWRGRQWHV
TXH HYROXFLRQDURQ D HOHIDQWHV
I (VSHFLDFLyQ 5XSWXUD HQ OD HYROXFLyQ ILOpWLFD TXH VXSRQH OD DSDULFLyQ
GH QXHYDV HVSHFLHV WDQWR HQ PRUIRORJtD FRPR HQ Q~PHUR /D
HVSHFLDFLyQ VH UHDOL]D HQ GRV IDVHV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-62-320.jpg)

![,QWHUUXSFLyQ GHO LQWHUFDPELR GH
PDWHULDO JHQpWLFR FRQ RWURV PLHPEURV GH
OD SREODFLyQ (O SURFHVR HV JUDGXDO
UHYHUVLEOH KDVWD XQ GHWHUPLQDGR SXQWR
/D LQWHUUXSFLyQ VH SXHGH FRQVHJXLU SRU
x (VSHFLDFLyQ DORSiWULGD 6L ODV
SREODFLRQHV TXHGDQ DLVODGDV
JHRJUiILFDPHQWH ORV JUXSRV GLYHUJHQ
JHQpWLFDPHQWH GLVPLQXH OD
YDULDELOLGDG GH KtEULGRV (M ODV
HVSHFLHV GH SLQ]RQHV GHO DUFKLSLpODJR
GH ODV *DOiSDJRV
x (VSHFLDFLyQ VLPSiWULGD 6RQ
PHFDQLVPR GH DVLODPLHQWR HFROyJLFR
HWROyJLFR«](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-64-320.jpg)


![GHELGR D OD DGDSWDFLyQ D GLIHUHQWHV
PHGLRV DPELHQWHV OR TXH FRQGLFLRQD OD FUHDFLyQ GH QXHYDV HVSHFLHV PX
VHPHMDQWHV HQWUH Vt SHUR GLIHUHQWHV HQ DOJXQRV FDUDFWHUHV (O SURFHVR VH
GHQRPLQD UDGLDFLyQ HYROXWLYD R HYROXFLyQ GLYHUJHQWH FRPR RFXUULy FRQ ORV
SLQ]RQHV GH ODV *DOiSDJRV TXH VRQ PX VHPHMDQWHV HQWUH Vt SHUR TXH VH
GLIHUHQFLDQ HQ HO WLSR GH SLFRV TXH SRVHHQ DGDSWDGRV D ORV WLSRV GH
DOLPHQWDFLyQ TXH KD HQ ODV GLVWLQWDV LVODV 7DPELpQ VH VXHOHQ FDPELRV
VHPHMDQWHV HQ GLVWLQWDV HVSHFLHV GHELGR D OD SUHVLyQ GHO PHGLR TXH RULJLQD
VHUHV YLYRV VHPHMDQWHV HQ DOJXQR GH VXV FDUDFWHUHV SHUR GH GLVWLQWDV
HVSHFLHV HVWH SURFHVR VH GHQRPLQD HYROXFLyQ FRQYHUJHQWH](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-67-320.jpg)
![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
/D PDFURHYROXFLyQ HV HO GHVDUUROOR GH JUDQGHV FDPELRV GLIHUHQFLDOHV
HQ ODV SREODFLRQHV GHELGR
D XQ DFXPXOR GH
PXWDFLRQHV HQ OD
SREODFLyQ SUHH[LVWHQWH
TXH KDFH TXH VH IRUPHQ
SREODFLRQHV PX
GLIHUHQWHV HQWUH Vt FRPR
RFXUULy HQ OD HYROXFLyQ GH
UHSWLOHV KDFLD DYHV
PDPtIHURV
358(%$6 '( /$ (92/8,Ð1
/DV SUXHEDV GH OD HYROXFLyQ VH FODVLILFDQ HQ GRV JUDQGHV JUXSRV
3UXHEDV FOiVLFDV 6RQ ODV XWLOL]DGDV SRU 'DUZLQ SRVWHULRUHV SDUD
H[SOLFDUOD HYROXFLyQ GH ODV HVSHFLHV SXHGHQ VHU
3UXHEDV GH PRUIRORJtD DQDWRPtD FRPSDUDGD
6H REVHUYD TXH HVSHFLHV GH KiELWDWV DLVODGRV PRQWDxDV LVODV
RFHiQLFDV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-68-320.jpg)
![WLHQHQ LQGLFLRV PRUIROyJLFRV GH WHQHU XQD HVSHFLH
DQFHVWUDO FRP~Q SRUTXH VRQ PX VLPLODUHV HQ PRUIRORJtD VH
GLIHUHQFLDQ VyOR HQ DOJXQRV FDUDFWHUHV TXH VH H[SOLFDQ FRPR
FRQVHFXHQFLD GH OD DGDSWDFLyQ DO PHGLR DPELHQWH GRQGH YLYHQ 7DO HV
HO FDVR GH ORV 3LQ]RQHV GH ODV *DOiSDJRV PX VLPLODUHV HQWUH Vt
VLPLODUHV D ORV SLQ]RQHV JUDQtYRURV WHUUHVWUHV GHO (FXDGRU KHFKR
TXH VH H[SOLFD DGPLWLHQGR TXH HQ HO SDVDGR HO SLQ]yQ GHO (FXDGRU
HPLJUy D ODV LVODV DTXt VH DGDSWy D ODV GLVWLQWDV FRQGLFLRQHV GH ODV
GLVWLQWDV LVODV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-69-320.jpg)
![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
RPSDUDQGR OD DQDWRPtD GH GLVWLQWRV VHUHV YLYRV VH GHWHUPLQDQ
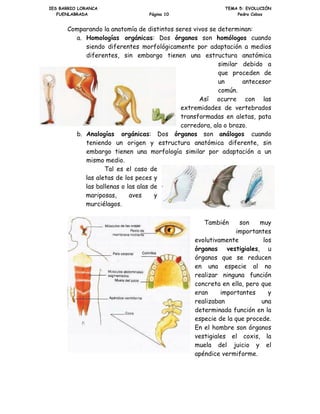
D +RPRORJtDV RUJiQLFDV 'RV yUJDQRV VRQ KRPyORJRV FXDQGR
VLHQGR GLIHUHQWHV PRUIROyJLFDPHQWH SRU DGDSWDFLyQ D PHGLRV
GLIHUHQWHV VLQ HPEDUJR WLHQHQ XQD HVWUXFWXUD DQDWyPLFD
VLPLODU GHELGR D
TXH SURFHGHQ GH
XQ DQWHFHVRU
FRP~Q
$Vt RFXUUH FRQ ODV
H[WUHPLGDGHV GH YHUWHEUDGRV
WUDQVIRUPDGDV HQ DOHWDV SDWD
FRUUHGRUD DOD R EUD]R
E $QDORJtDV RUJiQLFDV 'RV yUJDQRV VRQ DQiORJRV FXDQGR
WHQLHQGR XQ RULJHQ HVWUXFWXUD DQDWyPLFD GLIHUHQWH VLQ
HPEDUJR WLHQHQ XQD PRUIRORJtD VLPLODU SRU DGDSWDFLyQ D XQ
PLVPR PHGLR
7DO HV HO FDVR GH
ODV DOHWDV GH ORV SHFHV
ODV EDOOHQDV R ODV DODV GH
PDULSRVDV DYHV
PXUFLpODJRV
7DPELpQ VRQ PX
LPSRUWDQWHV
HYROXWLYDPHQWH ORV
yUJDQRV YHVWLJLDOHV X
yUJDQRV TXH VH UHGXFHQ
HQ XQD HVSHFLH DO QR
UHDOL]DU QLQJXQD IXQFLyQ
FRQFUHWD HQ HOOD SHUR TXH
HUDQ LPSRUWDQWHV
UHDOL]DEDQ XQD
GHWHUPLQDGD IXQFLyQ HQ OD
HVSHFLH GH OD TXH SURFHGH
(Q HO KRPEUH VRQ yUJDQRV
YHVWLJLDOHV HO FR[LV OD
PXHOD GHO MXLFLR HO
DSpQGLFH YHUPLIRUPH](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-70-320.jpg)
![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
3UXHEDV SDOHRQWROyJLFDV
/D 3DOHRQWRORJtD HV OD FLHQFLD TXH VH RFXSD GHO HVWXGLR GH ORV
IyVLOHV QRV KD DSRUWDGR PXFKDV SUXHEDV TXH UHODFLRQDQ ORV VHUHV
YLYRV GHO SDVDGR FRQ ORV
DFWXDOHV SHUPLWLpQGRQRV
HVWDEOHFHU OtQHDV GH HYROXFLyQ
DO FRPSUREDU TXH DOJXQRV
yUJDQRV WLHQHQ XQD HYROXFLyQ
SURJUHVLYD
$Vt RFXUUH FRQ OD
HYROXFLyQ GH ORV FDEDOORV GHVGH
(RKLSSXV FRQ FXDWUR GHGRV HQ
OD SDWD D (TXXV FRQ XQ GHGR
SRU XQD DGDSWDFLyQ D OD
FDUUHUD
3UXHEDV ELRJHRJUiILFDV
6H UHILHUHQ DO KHFKR GH TXH KD VHUHV YLYRV TXH VRQ H[FOXVLYRV
GH XQD GHWHUPLQDGD ]RQD SRUTXH KD KDELGR XQD EDUUHUD
ELRJUHRJUiILFD TXH KD LPSHGLGR VX H[SDQVLyQ FRPR RFXUUH FRQ HO
FDQJXUR R HO NRDOD GRV PDUVXSLDOHV GH $XVWUDOLD ~QLFRV HQ HO PXQGR
SRU HVWDU HVWD WLHUUD DLVODGD GHO UHVWR GH FRQWLQHQWHV
7DPELpQ ODV SUXHEDV ELRJHRJUiILFDV QRV LQIRUPDQ GH OD
SUR[LPLGDG GH FRQWLQHQWHV VHSDUDGRV HQ OD DFWXDOLGDG FRPR RFXUUH
FRQ ORV FDPpOLGRV DIULFDQRV GURPHGDULR FDPHOOR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-71-320.jpg)

![SRU OR TXH VHUtD OD VHSDUDFLyQ GH ORV
FRQWLQHQWHV OD FDXVD GH OD HVSHFLDFLyQ VH TXH SURGXFH HQ HOORV
3UXHEDV HPEULROyJLFDV
6H EDVD HQ HO HVWXGLR GH ORV HPEULRQHV SDUD H[WUDHU
VHPHMDQ]DV R GLIHUHQFLDV HYROXWLYDV
$Vt VH REVHUYD TXH ORV HPEULRQHV GH
ORV YHUWHEUDGRV VRQ PX VHPHMDQWHV
HQWUH Vt KDVWD XQ GHWHUPLQDGR
PRPHQWR LQGLFDQGR FRQ HOOR HO RULJHQ
FRP~Q GH ORV PLVPRV 3RU HOOR VH GLFH
TXH HO GHVDUUROOR HPEULRQDULR X
RQWRJHQLD HV UHIOHMR GHO GHVDUUROOR
HYROXWLYR R ILORJHQLD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-73-320.jpg)
![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
3UXHEDV DFWXDOHV (VWiQ EDVDGDV HQ ELRORJtD PROHFXODU VRQ
,QPXQROyJLFDV
XDQGR XQD SDUWtFXOD H[WUDxD R DQWtJHQR SHQHWUD HQ XQ VHU YLYR
pVWH SURGXFH XQD UHDFFLyQ GHIHQVLYD IUHQWH D pO SURGXFLHQGR XQDV
SURWHtQDV HVSHFtILFDV R DQWLFXHUSR TXH VH XQHQ DO DQWtJHQR SDUD
QHXWUDOL]DUOR $ OD UHDFFLyQ VH OD GHQRPLQD ´UHDFFLyQ DQWtJHQR
DQWLFXHUSRµ 6H FRPSUXHED TXH ODV UHDFFLRQHV DQWtJHQRDQWLFXHUSR
VRQ WDQWR PiV YLUXOHQWDV FXDQWR PiV DOHMDGDV ILORJHQpWLFDPHQWH HVWiQ
ODV HVSHFLHV
6HFXHQFLDFLyQ GH SURWHtQDV
$O FRPSDUDU OD PLVPD SURWHtQD GH GRV HVSHFLHV GLVWLQWDV
SRGHPRV VDEHU VL HVWiQ PiV R PHQRV HPSDUHQWDGDV GHSHQGLHQGR GH
ODV GLIHUHQFLDV TXH KDD HQWUH HOODV (V PX XWLOL]DGD OD FRPSDUDFLyQ
GH KHPRJORELQD PLRJORELQD HQ DQLPDOHV OD FRPSDUDFLyQ GH
SLJPHQWRV IRWRVLQWHWL]DGRUHV HQ SODQWDV
+LEULGDFLyQ
/DV GRV KHEUDV GH ODV PROpFXODV GH $'1 SXHGHQ VHSDUDUVH EDMR
GHWHUPLQDGDV FRQGLFLRQHV IHQyPHQR GHQRPLQDGR GHVQDWXUDOL]DFLyQ
(VWD SURSLHGDG VH XWLOL]DGD SDUD FRPSDUDU HO JUDGR GH DSDUHDPLHQWR
KLEULGDFLyQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-74-320.jpg)
![GH $'1V GH HVSHFLHV GLVWLQWDV DO PH]FODU $'1
GHVQDWXUDOL]DGR GH GLFKDV HVSHFLHV SXGLHQGR H[WUDHU FRQFOXVLRQHV
VREUH VX SUR[LPLGDG HYROXWLYD GHSHQGLHQGR GHO JUDGR GH
DSDUHDPLHQWR GH VXV $'1V UHVSHFWLYRV D TXH D PDRU DSDUHDPLHQWR
PDRU SUR[LPLGDG HQ OD HYROXFLyQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-75-320.jpg)











































































































































































![%,2(/(0(1726 %,202/e8/$6
4. Clasificación
- Ver cuadro.
5. Enzimas
a. Concepto
- Biocatalizadores. Proteínas globulares que aceleran las reacciones bioquímicas (unas 10
7
veces).
Cada reacción que se produce en el organismo es catalizada por un enzima.
- Pueden ser holo- o heteroproteínas. En este último caso, la parte constituida por aminoácidos se
denomina Apoenzima (no activo), el grupo prostético se denomina cofactor y la unión de ambos es el
Holoenzima (activo).
- Los reactivos sobre los cuales actúan los enzimas se conocen como sustratos.
b. Propiedades
- Gran poder catalítico: son muy activas. Una pequeña cantidad de enzima es capaz de catalizar la
transformación de una gran cantidad de sustrato. Además aceleran mucho las reacciones (del orden
de 10
7
veces).
- No se gastan ni alteran durante la catálisis: son reutilizables.
- Altamente específicos: presentan especificidad de sustrato y de acción. Como el resto de las proteí-
nas son además característicos de cada especie.
c. Características de la actividad enzimática
- Reducen la energía de activación. Permiten que las reacciones bioquímicas transcurran rápidamente
y a bajas temperaturas (compatible con el mantenimiento de estructuras complejas).
- Poseen un centro activo. Zona de la molécula donde se une el sustrato. Al unirse enzima y sustrato
forman el complejo enzima-sustrato que luego se separará en enzima (listo para actuar otra vez) y
producto(s).
E + S → ES → E + P
Dos modelos para explicar la unión entre enzima y sustrato: la llave y la cerradura (formas com-
plementarias de centro activo y sustrato) y encaje inducido (la forma del centro activo se adapta a
la del sustrato cuando se produce la unión). No son incompatibles; pueden darse los dos modelos,
dependiendo del grado de especificidad del enzima.
- Presentan saturación con el sustrato. Alcanzan una vmáx, para una determinada concentración de
sustrato, cuando el enzima está trabajando a su máximo rendimiento (todos los centros activos están
ocupados en un instante determinado).
- Muchos enzimas requieren de cofactores: moléculas no proteicas que se unen al centro activo del
enzima y realizan o colaboran en la realización de la reacción. Los cofactores pueden ser:
Activadores inorgánicos: iones metálicos.
Coenzimas: moléculas orgánicas complejas.
d. Factores que influyen en la actividad enzimática
Temperatura
- La velocidad de las reacciones catalizadas enzimáticamente aumenta al aumentar la temperatura
hasta alcanzar su máxima actividad para una temperatura conocida como temperatura óptima. Por
encima de esa temperatura el enzima se hace inestable y se desnaturaliza, perdiendo su activi-
dad.
pH
- Cada enzima tiene un pH óptimo para el cual la actividad es máxima.
Inhibidores
- Los inhibidores son sustancias que impiden o reducen la actividad de un enzima. Pueden ser:
Irreversibles. Unión covalente. Algunos venenos inhiben así a ciertos enzimas.
Reversibles. No se altera el enzima, sólo se impide su acción. Tienen interés en la regulación de la
actividad enzimática.
Inhibición competitiva. El inhibidor se une al centro activo. La inhibición dependerá de las con-
centraciones relativas de enzima e inhibidor: si [S][I] el enzima estará activo; si [I][S] estará in-
activo)
Inhibición no competitiva. El inhibidor se une a un lugar distinto del centro activo (enzimas alosté-
ricos). El que el enzima esté activo o no depende de la concentración del inhibidor y es indepen-
diente de la concentración del sustrato.
e. Regulación de la actividad enzimática
- Dada su gran poder catalítico es importante regular la actividad de los enzimas para evitar su acción
cuando no son necesarios los productos que generan. Además, como las reacciones no catalizadas
son muy lentas, la regulación de la actividad enzimática es la mejor manera de regular el metabolis-
mo.
- El principal mecanismo de regulación de la actividad enzimática es la retroinhibición. Consiste en que
el producto final de una ruta metabólica actúa inhibiendo al primer enzima que interviene en la mis-
ma, bloqueando el proceso completo cuando la concentración del producto es elevada. En las rutas
ramificadas el producto final de cada ramificación actúa inhibiendo el primer enzima que interviene
en dicha ramificación.](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-247-320.jpg)













![3/5
4.- El agua es el líquido que más sustancias disuelve (disolvente universal).
Esta propiedad, tal
vez la más importante
para la vida, se debe
a su capacidad para
formar puentes de H,
además de con otras
moléculas de agua
como se dijo
anteriormente, con
otras sustancias
polares (grupos -OH
de alcoholes y
azúcares, grupos -NH2
de aminoácidos, proteínas, ácidos nucleicos, etc.), pues se disuelven cuando
interaccionan con las moléculas del agua.
5.- El agua posee un elevado calor específico. Se denomina calor específico a
la capacidad de almacenar energía para un aumento determinado de la temperatura: el
agua puede absorber grandes cantidades de calor, mientras que, proporcionalmente, su
temperatura sólo se eleva ligeramente. Del mismo modo, su temperatura desciende con
más lentitud que la de otros líquidos a medida que va liberando energía al enfriarse. Esta
propiedad permite que el contenido acuoso de las células sirva de protección a las
sensibles moléculas orgánicas ante los cambios bruscos de temperatura. Además, el calor
que se desprende en los procesos metabólicos no se acumula en los lugares donde se
produce, sino que se difunde en el medio acuoso y se disipa finalmente hacia el medio
externo.
6.- El agua posee una elevada fuerza de cohesión entre sus moléculas. Los
puentes de H mantienen a las moléculas de agua
fuertemente unidas, formando una estructura compacta
que la convierte en un líquido casi incompresible. Gracias a
esta propiedad algunos seres vivos utilizan el agua como
esqueleto hidrostático.
7.- El agua posee una elevada fuerza de
adhesión. Esta fuerza está también en relación con los
puentes de H que se establecen entre las moléculas de
agua y otras moléculas polares y es responsable, junto con
la cohesión, del llamado fenómeno de la capilaridad, es
decir, el ascenso de agua a través de las paredes de un capilar (delgado tubo de vidrio).
Los seres vivos van renovando continuamente su contenido en agua,
ingiriéndola con la alimentación y perdiéndola con la respiración como vapor y con la
excreción (orina, sudor, etc.)
2.3. SALES MINERALES: PROPIEDADES E IMPORTANCIA BIOLÓGICA
En todos los seres vivos, animales y vegetales, se encuentran siempre
determinadas cantidades de sales minerales. Se clasifican en función de su solubilidad en
agua. Las sustancias salinas insolubles en agua forman estructuras sólidas que suelen
cumplir funciones de protección y sostén y que están muy extendidas en todos los seres
vivos. Los Crustáceos y los Moluscos presentan caparazones de carbonato cálcico
(CO3Ca) mientras que en la Diatomeas son de sílice (SiO2). El esqueleto interno de los
Vertebrados presenta una parte mineral formada por la asociación de varios
componentes minerales, sobre todo carbonato y fosfato cálcico [(PO4)2Ca3]. Además, el
esmalte de los dientes presenta fluoruro cálcico (F2Ca).
En cuanto a las sales minerales solubles en agua, éstas se encuentran
disociadas en sus iones correspondientes, que son los responsables de su actividad
biológica. Los principales iones son:](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-261-320.jpg)
![4/5
Ÿ Cationes: Na+
, K+
, Mg2+
, Ca2+
y amonio (NH4
+
).
Ÿ Aniones: Cl-
, fosfatos (PO4
3-
, PO4H2
-
, PO4H2
-
), sulfato (SO4
2-
), nitrato (NO3
-
) y carbonatos (CO3
2-
, CO3H-
).
Los iones minerales realizan múltiples funciones en el organismo, destacando
las siguientes:
1.3.1.- Regulación de los fenómenos osmóticos: cuando dos disoluciones
salinas de distinta concentración se ponen en contacto a través de una membrana
semipermeable (llamada así porque permite el paso de agua pero no de los iones
disueltos en ella) las dos disoluciones tienden a equilibrar sus concentraciones y, como
los iones no pueden atravesar la membrana, es el agua de la disolución más diluida la
que va pasando a la más concentrada. Este trasiego de agua cesa cuando ambas
disoluciones adquieren la misma concentración. La disolución más concentrada recibe el
nombre de hipertónica respecto a la menos concentrada que es la hipotónica; en el
momento del equilibrio se dice que las dos disoluciones son isotónicas. Este fenómeno se
conoce con el nombre de ósmosis y el paso del agua a través de la membrana
semipermeable genera una presión llamada presión osmótica. Esta será mayor cuanto
mayor sea la diferencia en la concentración de las dos disoluciones. Los seres vivos
mantienen en sus células una presión osmótica constante gracias a las sales minerales,
fenómeno llamado homoósmia, y son muy sensibles a las variaciones de la misma, lo
cual acarrea serios trastornos. Por esta razón toda disolución que se ponga en contacto
directo con las células de un organismo debe ser isotónica con respecto a la disolución
salina de su interior, ya que las membranas celulares se comportan como
semipermeables. Existen dos ejemplos típicos que demuestran la importancia de los
fenómenos osmóticos en el mantenimiento de la integridad celular:
1.- Las células vegetales poseen una gran vacuola que comprime el
citoplasma contra la pared celular. Al ponerlas en contacto con una solución salina
hipertónica respecto del líquido de la vacuola, el agua de ésta fluye hacia el exterior de la
célula y, como consecuencia, la vacuola se reduce de tamaño arrastrando al citoplasma,
que puede llegar a separarse de la pared celular. Este fenómeno se denomina
plasmólisis. Por el contrario, si la solución que se pone en contacto con la célula es
hipotónica, la corriente de agua se establece hacia el interior, comprimiendo el
citoplasma contra la pared celular. Este caso se llama turgencia.
2.- Repitiendo la misma experiencia con glóbulos rojos, como éstos carecen
de pared celular vegetal, al ponerlos en contacto con una solución hipertónica,
disminuyen de volumen y se arrugan al salir agua al exterior. Si los ponemos en contacto
con una solución hipotónica, el agua pasa al interior y el glóbulo rojo se dilata, pudiendo
llegar a estallar rompiéndose su membrana. Este caso extremo se llama hemolisis.
1.3.2.- Regulación del equilibrio ácido-base: En los seres vivos existe siempre
una cierta cantidad de hidrogeniones (H+
) y de iones hidroxilo (OH-
) que proceden de:
a) La disociación del agua que proporciona los dos iones: H2O H+
+
OH-
b) La disociación de cuerpos con función ácida que proporcionan H+
: ClH
Cl-
+ H+
c) La disociación de cuerpos con función básica que proporcionan OH-
:NaOH
Na+
+ OH-
Los hidrogeniones tienen carácter ácido, mientras que los hidroxiliones lo
tienen alcalino. Por lo tanto la acidez o alcalinidad del medio interno de un organismo
dependerá de la proporción en que se encuentren los dos iones. Así será neutro cuando
[H+
]=[OH-
], ácido cuando [H+
][OH-
] y alcalino cuando [H+
][OH-
]. Para que los
fenómenos vitales puedan desarrollarse con normalidad es necesario que la
concentración de H+, que se expresa en valores de pH sea más o menos constante y
próxima a la neutralidad, es decir, pH=7. Sin embargo, en las reacciones que tienen
lugar durante el metabolismo se están liberando productos tanto ácidos como básicos
que tenderán a variar dicha neutralidad si no fuera porque los organismos disponen de
unos mecanismos químicos que se oponen automáticamente a las variaciones de pH.
Estos mecanismos se denominan sistemas amortiguadores o sistemas tampón, y en ellos
intervienen de forma fundamental las sales minerales. Lo más corriente es que el pH](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-262-320.jpg)






![/D PROpFXOD GHO DJXD HV XQ GLSROR 'HELGR D OD HOHFWURQHJDWLYLGDG GHO R[tJHQR
ORV HOHFWURQHV GH ORV KLGUyJHQRV VH GHVSOD]DQ KDFLD pVWH FDUJiQGRVH QHJDWLYDPHQWH HO
SROR GH OD PROpFXOD TXH RFXSD HO R[tJHQR DSDUHFLHQGR GRV SRORV SRVLWLYRV HQ ORV
KLGUyJHQRV
(QWUH ORV GLSRORV VH HVWDEOHFHQ IXHU]DV GH DWUDFFLyQ GHQRPLQDGDV SXHQWHV GH
KLGUyJHQR GH IRUPD TXH VH IRUPDQ PDFURPROpFXODV GH KDVWD PROpFXODV FRH[LVWLHQGR
pVWDV FRQ PROpFXODV DLVODGDV OR TXH GHWHUPLQD TXH HO DJXD SUHVHQWH PDRU SHVR
PROHFXODU VH SUHVHQWH HQ HVWDGR OtTXLGR $Vt VH IRUPD XQD HVWUXFWXUD RUGHQDGD
UHVSRQVDEOH GHO FRPSRUWDPLHQWR FDUDFWHUtVWLFR GHO DJXD DVt FRPR GH VXV SURSLHGDGHV
ItVLFDV TXtPLFDV
3URSLHGDGHV ItVLFR TXtPLFDV GHO DJXD
$FFLyQ GLVROYHQWH 6H OH FRQVLGHUD HO GLVROYHQWH XQLYHUVDO D TXH HV FDSD]
HVWDEOHFHU LQWHUDFFLRQHV FRQ LRQHV R PROpFXODV SRODUHV SURYRFDQGR VX GLVSHUVLyQ R
GLVROXFLyQ /DV PROpFXODV GH DJXD VH GLVSRQHQ DOUHGHGRU GH ORV LRQHV SRVLWLYRV FRQ OD
SDUWH QHJDWLYD GH VX PROpFXOD KDFLD HOORV HQ HO FDVR GH ORV LRQHV QHJDWLYRV
HQIUHQWDQGR VX SDUWH SRVLWLYD FRQVLJXLHQGR DVt DWUDHUORV 6H IRUPD DVt XQD FDSD GH
VROYDWDFLyQ DOUHGHGRU GH ORV PLVPRV TXH ORV LQGHSHQGL]D GLVSHUVD HQ HO VHQR DFXRVR
DSD GH VROYDWDFLyQ HQ WRUQR D XQ LyQ SRVLWLYR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-269-320.jpg)
![/D FDSDFLGDG GLVROYHQWH HV OD UHVSRQVDEOH GH GRV IXQFLRQHV
+DFH GHO DJXD HO PHGLR LGHDO SDUD TXH VH GHVDUUROOHQ ODV UHDFFLRQHV GHO PHWDEROLVPR
HQ HO LQWHULRU FHOXODU
6H FRQVWLWXH FRPR XQ HILFD] PHGLR GH WUDQVSRUWH GH VXVWDQFLDV DSRUWH GH
QXWULHQWHV HOLPLQDFLyQ GH GHVHFKRV
(OHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV PROpFXODV /RV SXHQWHV GH KLGUyJHQR
PDQWLHQHQ ODV PROpFXODV GH DJXD IXHUWHPHQWH XQLGDV IRUPDQGR XQD HVWUXFWXUD FRPSDFWD
TXH OD FRQYLHUWH HQ XQ OtTXLGR FDVL LQFRPSUHQVLEOH $O QR SRGHU FRPSULPLUVH SXHGH
WHQHU OD IXQFLyQ HQ DOJXQRV DQLPDOHV GH HVTXHOHWR KLGURVWiWLFR FRPR RFXUUH HQ
DOJXQRV JXVDQRV SHUPLWH GDU YROXPHQ D ODV FpOXODV 7DPELpQ H[SOLFD OD IXQFLyQ
PHFiQLFD DPRUWLJXDGRUD TXH HMHUFH HQ ODV DUWLFXODFLRQHV OtTXLGR VLQRYLDO](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-270-320.jpg)
![(OHYDGD IXHU]D GH DGKHVLyQ 6H GHEH DO HVWDEOHFLPLHQWR GH SXHQWHV GH
KLGUyJHQR HQWUH ODV PROpFXODV GH DJXD RWUDV PROpFXODV SRODUHV HV UHVSRQVDEOH MXQWR
FRQ OD FRKHVLyQ GHO OODPDGR IHQyPHQR GH OD FDSLODULGDG XDQGR VH LQWURGXFH XQ
FDSLODU WXER GH SHTXHxR GLiPHWUR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-271-320.jpg)
![HQ XQ UHFLSLHQWH FRQ DJXD pVWD DVFLHQGH SRU HO
FDSLODU FRPR VL WUHSDVH DJDUUiQGRVH SRU ODV SDUHGHV KDVWD DOFDQ]DU XQ QLYHO VXSHULRU DO
GHO UHFLSLHQWH $ HVWH IHQyPHQR VH GHEH HQ SDUWH OD DVFHQVLyQ GH OD VDYLD EUXWD GHVGH ODV
UDtFHV KDVWD ODV KRMDV D WUDYpV GH ORV YDVRV OHxRVRV
*UDQ FDORU HVSHFtILFR (O FDORU HVSHFtILFR VH GHILQH FRPR OD FDQWLGDG GH FDORU
QHFHVDULD SDUD HOHYDU ž OD WHPSHUDWXUD GH JU GH DJXD (VWR KDFH TXH HO DJXD
DOPDFHQH R OLEHUH XQD JUDQ FDQWLGDG GH FDORU DO FDOHQWDUVH R DO HQIULDUVH OR TXH SHUPLWH
TXH HO DJXD DFW~H FRPR DPRUWLJXDGRU WpUPLFR HYLWDQGR EUXVFDV DOWHUDFLRQHV GH OD
WHPSHUDWXUD HYLWDQGR GH HVWD IRUPD TXH SRU HMHPSOR DOJXQDV PROpFXODV FRPR ODV
SURWHtQDV PX VHQVLEOHV D ORV FDPELRV WpUPLFRV VH DOWHUHQ $Vt VH PDQWLHQH OD
WHPSHUDWXUD FRQVWDQWH )XQFLyQ WHUPRUUHJXODGRUD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-272-320.jpg)
![(OHYDGR FDORU GH YDSRUDFLyQ (O FDORU GH YDSRUL]DFLyQ HV HO TXH VH QHFHVLWD
VXPLQLVWUDU DO DJXD SDUD TXH FDPELH GHO HVWDGR OtTXLGR DO JDVHRVR HYDSRUL]DFLyQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-273-320.jpg)
![3DUD
HOOR HV QHFHVDULR URPSHU ORV SXHQWHV GH KLGUyJHQR SRU OR TXH VH QHFHVLWD VXPLQLVWUDU HO
FDORU VXILFLHQWH SDUD HOOR 'H DKt TXH HO DJXD FDPELH GH HVWDGR D ORV ž (O VXGRU TXH
VHJUHJDQ ORV VHUHV YLYRV SHUPLWH DFXPXODU HO H[FHVR GH FDORU GHO RUJDQLVPR DO
HYDSRUDUVH HOLPLQDUOR FRQ SRFD SpUGLGD GH DJXD DFWXDQGR DVt FRPR UHJXODGRU
WpUPLFR
(OHYDGD WHQVLyQ VXSHUILFLDO /DV PROpFXODV GH OD VXSHUILFLH GHO DJXD
H[SHULPHQWDQ IXHU]DV GH DWUDFFLyQ KDFLD HO LQWHULRU GHO OtTXLGR (VWR IDYRUHFH TXH GLFKD
VXSHUILFLH RSRQJD XQD JUDQ UHVLVWHQFLD D VHU WUDVSDVDGD RULJLQD XQD ³SHOtFXOD
VXSHUILFLDO´ TXH SHUPLWH SRU HMHPSOR HO GHVSOD]DPLHQWR VREUH HOOD GH DOJXQRV
RUJDQLVPRV
'HQVLGDG (O DJXD HQ HVWDGR OtTXLGR HV PDV GHQVD TXH HQ HVWDGR VyOLGR (VWR
SHUPLWH OD YLGD DFXiWLFD HQ FOLPDV IUtRV D TXH DO GHVFHQGHU OD WHPSHUDWXUD VH IRUPD
XQD FDSD GH KLHOR HQ OD VXSHUILFLH TXH IORWD SURWHJH DO DJXD OtTXLGD TXH TXHGD EDMR
HOOD
)XQFLRQHV GHO DJXD HQ ORV VHUHV YLYRV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-274-320.jpg)
!['HULYDQ GH ODV SURSLHGDGHV ItVLFRTXtPLFDV DQWHULRUPHQWH H[SOLFDGDV
)XQFLyQ GH GLVROYHQWH XQLYHUVDO UHODFLRQDGD FRQ VX HVWUXFWXUD GLSRODU
)XQFLyQ HVWUXFWXUDO
)XQFLyQ WUDQVSRUWDGRUD HQ UHODFLyQ WDPELpQ FRQ VX HVWUXFWXUD GLSRODU VX HOHYDGD
IXHU]D GH DGKHVLyQ
)XQFLyQ WHUPRUUHJXODGRUD FRQGLFLRQDGD SRU VX JUDQ FDORU HVSHFtILFR FDORU GH
YDSRUL]DFLyQ
)XQFLyQ DPRUWLJXDGRUD UHODFLRQDGD FRQ OD HOHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV
PROpFXODV
)XQFLyQ UHDFWLYD OR TXH HVWi UHODFLRQDGR FRQ VX HVWUXFWXUD GLSRODU
/26 )/8Ë'26 (1 /26 6(5(6 9,926
(O HVWXGLR GH ODV GLVROXFLRQHV HV IXQGDPHQWDO SDUD FRPSUHQGHU OD PDRU SDUWH GH ORV
SURFHVRV ELROyJLFRV TXH RFXUUHQ HQ HO LQWHULRU GH ORV VHUHV YLYRV
/RV IOXLGRV SUHVHQWHV HQ ORV VHUHV YLYRV FRQVWDQ GH XQD IDVH GLVSHUVDQWH TXH HV DFXRVD
GH XQD IDVH GLVSHUVD R VROXWR IRUPDGD SRU SDUWtFXODV GH SHTXHxR WDPDxR
6HJ~Q HO WDPDxR GH ODV SDUWtFXODV GH OD IDVH GLVSHUVD VH SXHGHQ FODVLILFDU HQ
'LVROXFLRQHV YHUGDGHUDV 6L HO WDPDxR HV LQIHULRU D QP /DV SDUWtFXODV
GLVXHOWDV VRQ LRQHV PROpFXODV DLVODGDV R SHTXHxDV DJUXSDFLRQHV TXH QR VHGLPHQWDQ
'LVSHUVLRQHV FRORLGDOHV 6L HO WDPDxR HVWi HQWUH QP /DV SDUWtFXODV QR
VHGLPHQWDQ SHUR UHIOHMDQ UHIUDFWDQ OD OX] TXH LQFLGH VREUH HOODV
8Q GH ORV SURFHVRV ItVLFRTXtPLFRV PiV LPSRUWDQWHV TXH WLHQHQ OXJDU HQ ODV GLVROXFLRQHV
YHUGDGHUDV HV OD yVPRVLV
Ï6026,6
/D yVPRVLV HV XQ SURFHVR ItVLFRTXtPLFR FRQVLVWHQWH HQ HO SDVR GHO GLVROYHQWH GH XQD
GLVROXFLyQ QR GHO VROXWR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-275-320.jpg)
![D WUDYpV GH XQD PHPEUDQD VHPLSHUPHDEOH (O SDVR GHO
GLVROYHQWH VH UHDOL]D VLHPSUH GHVGH OD VROXFLyQ PiV GLOXLGD KLSRWyQLFD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-276-320.jpg)




![x /$6 6$/(6 0,1(5$/(6
/DV VDOHV PLQHUDOHV VH SXHGHQ HQFRQWUDU HQ ORV VHUHV YLYRV HQ WUHV IRUPDV
6XVWDQFLDV PLQHUDOHV SUHFLSLWDGDV FRQVWLWXHQ HVWUXFWXUDV VyOLGDV LQVROXEOHV
FRQ QDWXUDOH]D HVTXHOpWLFD IRUPDQGR WDQWR H[RHVTXHOHWRV FRPR HQGRHVTXHOHWRV 3RU
HMHPSOR HO FDUERQDWR GH FDOFLR IRVIDWR GH FDOFLR OD VtOLFH HWF
6DOHV PLQHUDOHV GLVXHOWDV /DV VXVWDQFLDV PLQHUDOHV DO GLVROYHUVH HQ HO PHGLR
LQWHUQR DFXRVR GDQ OXJDU D DQLRQHV FDWLRQHV (VWRV LRQHV PDQWLHQHQ FRQVWDQWH HO JUDGR
GH VDOLQLGDG GHQWUR GHO RUJDQLVPR DXGDQ D PDQWHQHU HO JUDGR GH DFLGH] S+](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-281-320.jpg)
![OR TXH
HV LPSUHVFLQGLEOH SDUD HO FRUUHFWR GHVDUUROOR GH ODV UHDFFLRQHV PHWDEyOLFDV FHOXODUHV (O
PHGLR LQWHUQR GH ORV RUJDQLVPRV SUHVHQWD XQDV FRQFHQWUDFLRQHV LyQLFDV FRQVWDQWHV GH
KHFKR FXDOTXLHU YDULDFLyQ SURYRFD DOWHUDFLRQHV LPSRUWDQWHV HQ OD GLQiPLFD FHOXODU /D
PDRU R PHQRU SUHVHQFLD GH VDOHV HQ HO PHGLR LQWHUQR FHOXODU GHWHUPLQD TXH VH
SURGX]FDQ IHQyPHQRV RVPyWLFRV TXH UHJXOHQ ODV FRQFHQWUDFLRQHV D DPERV ODGRV GH OD
PHPEUDQD FHOXODU FRQ OR TXH VH UHJXOD OD SUHVLyQ RVPyWLFD HO YROXPHQ FHOXODU
3DUD HYLWDU ODV YDULDFLRQHV GH S+ TXH FDXVDUtDQ WUDVWRUQRV JUDYHV HQ DOJXQRV
SURFHVRV PHWDEyOLFRV OD SpUGLGD GH OD FDSDFLGDG IXQFLRQDO GH PXFKDV HQ]LPDV
DOJXQDV VDOHV PLQHUDOHV GLVXHOWDV FXPSOHQ HVWD IXQFLyQ IRUPDQGR GLVROXFLRQHV WDPSyQ
R DPRUWLJXDGRUDV TXH FRPSHQVDQ HO H[FHVR R HO GpILFLW GH LRQHV HQ HO PHGLR
PDQWHQLHQGR FRQVWDQWH HO S+ (VWDV GLVROXFLRQHV HVWiQ IRUPDGDV SRU XQ iFLGR GpELO VX
EDVH FRQMXJDGD TXH DFW~DQ FRPR GDGRUHV R UHFHSWRUHV GH + UHJXODQGR DVt HO S+ D
TXH HO S+ ORJ +](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-282-320.jpg)
![8Q HMHPSOR HV HO VLVWHPD WDPSyQ IRVIDWR
+32 +32 +
6DOHV PLQHUDOHV
DVRFLDGDV D PROpFXODV
RUJiQLFDV QRUPDOPHQWH
DSDUHFHQ DVRFLDGDV D SURWHtQDV R OtSLGRV
6H UHFRPLHQGD FRQVXOWDU
KWWSZZZRXWXEHFRPZDWFKY 82Z%ZF/$ IHDWXUH UHODWHG
KWWSZZZRXWXEHFRPZDWFKY VGL-W'5-4(F IHDWXUH UHODWHG
$FLGLILFD
1HXWUDOL]D](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-283-320.jpg)


![/D PROpFXOD GHO DJXD HV XQ GLSROR 'HELGR D OD HOHFWURQHJDWLYLGDG GHO R[tJHQR
ORV HOHFWURQHV GH ORV KLGUyJHQRV VH GHVSOD]DQ KDFLD pVWH FDUJiQGRVH QHJDWLYDPHQWH HO
SROR GH OD PROpFXOD TXH RFXSD HO R[tJHQR DSDUHFLHQGR GRV SRORV SRVLWLYRV HQ ORV
KLGUyJHQRV
(QWUH ORV GLSRORV VH HVWDEOHFHQ IXHU]DV GH DWUDFFLyQ GHQRPLQDGDV SXHQWHV GH
KLGUyJHQR GH IRUPD TXH VH IRUPDQ PDFURPROpFXODV GH KDVWD PROpFXODV FRH[LVWLHQGR
pVWDV FRQ PROpFXODV DLVODGDV OR TXH GHWHUPLQD TXH HO DJXD SUHVHQWH PDRU SHVR
PROHFXODU VH SUHVHQWH HQ HVWDGR OtTXLGR $Vt VH IRUPD XQD HVWUXFWXUD RUGHQDGD
UHVSRQVDEOH GHO FRPSRUWDPLHQWR FDUDFWHUtVWLFR GHO DJXD DVt FRPR GH VXV SURSLHGDGHV
ItVLFDV TXtPLFDV
3URSLHGDGHV ItVLFR TXtPLFDV GHO DJXD
$FFLyQ GLVROYHQWH 6H OH FRQVLGHUD HO GLVROYHQWH XQLYHUVDO D TXH HV FDSD]
HVWDEOHFHU LQWHUDFFLRQHV FRQ LRQHV R PROpFXODV SRODUHV SURYRFDQGR VX GLVSHUVLyQ R
GLVROXFLyQ /DV PROpFXODV GH DJXD VH GLVSRQHQ DOUHGHGRU GH ORV LRQHV SRVLWLYRV FRQ OD
SDUWH QHJDWLYD GH VX PROpFXOD KDFLD HOORV HQ HO FDVR GH ORV LRQHV QHJDWLYRV
HQIUHQWDQGR VX SDUWH SRVLWLYD FRQVLJXLHQGR DVt DWUDHUORV 6H IRUPD DVt XQD FDSD GH
VROYDWDFLyQ DOUHGHGRU GH ORV PLVPRV TXH ORV LQGHSHQGL]D GLVSHUVD HQ HO VHQR DFXRVR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-286-320.jpg)
![DSD GH VROYDWDFLyQ HQ WRUQR D XQ LRQ SRVLWLYR
/D FDSDFLGDG GLVROYHQWH HV OD UHVSRQVDEOH GH GRV IXQFLRQHV
+DFH GHO DJXD HO PHGLR LGHDO SDUD TXH VH GHVDUUROOHQ ODV UHDFFLRQHV GHO PHWDEROLVPR
HQ HO LQWHULRU FHOXODU
6H FRQVWLWXH FRPR XQ HILFD] PHGLR GH WUDQVSRUWH GH VXVWDQFLDV DSRUWH GH
QXWULHQWHV HOLPLQDFLyQ GH GHVHFKRV
(OHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV PROpFXODV /RV SXHQWHV GH KLGUyJHQR
PDQWLHQHQ ODV PROpFXODV GH DJXD IXHUWHPHQWH XQLGDV IRUPDQGR XQD HVWUXFWXUD FRPSDFWD
TXH OD FRQYLHUWH HQ XQ OtTXLGR FDVL LQFRPSUHQVLEOH $O QR SRGHU FRPSULPLUVH SXHGH
WHQHU OD IXQFLyQ HQ DOJXQRV DQLPDOHV GH HVTXHOHWR KLGURVWiWLFR FRPR RFXUUH HQ
DOJXQRV JXVDQRV SHUPLWH GDU YROXPHQ D ODV FpOXODV 7DPELpQ H[SOLFD OD IXQFLyQ
PHFiQLFD DPRUWLJXDGRUD TXH HMHUFH HQ ODV DUWLFXODFLRQHV OtTXLGR VLQRYLDO](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-287-320.jpg)
![(OHYDGD IXHU]D GH DGKHVLyQ 6H GHEH DO HVWDEOHFLPLHQWR GH SXHQWHV GH
KLGUyJHQR HQWUH ODV PROpFXODV GH DJXD RWUDV PROpFXODV SRODUHV HV UHVSRQVDEOH MXQWR
FRQ OD FRKHVLyQ GHO OODPDGR IHQyPHQR GH OD FDSLODULGDG XDQGR VH LQWURGXFH XQ
FDSLODU WXER GH SHTXHxR GLiPHWUR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-288-320.jpg)
![HQ XQ UHFLSLHQWH FRQ DJXD pVWD DVFLHQGH SRU HO
FDSLODU FRPR VL WUHSDVH DJDUUiQGRVH SRU ODV SDUHGHV KDVWD DOFDQ]DU XQ QLYHO VXSHULRU DO
GHO UHFLSLHQWH $ HVWH IHQyPHQR VH GHEH HQ SDUWH OD DVFHQVLyQ GH OD VDYLD EUXWD GHVGH ODV
UDtFHV KDVWD ODV KRMDV D WUDYpV GH ORV YDVRV OHxRVRV
*UDQ FDORU HVSHFtILFR (O FDORU HVSHFtILFR VH GHILQH FRPR OD FDQWLGDG GH FDORU
QHFHVDULD SDUD HOHYDU ž OD WHPSHUDWXUD GH JU GH DJXD (VWR KDFH TXH HO DJXD
DOPDFHQH R OLEHUH XQD JUDQ FDQWLGDG GH FDORU DO FDOHQWDUVH R DO HQIULDUVH OR TXH SHUPLWH
TXH HO DJXD DFW~H FRPR DPRUWLJXDGRU WpUPLFR HYLWDQGR EUXVFDV DOWHUDFLRQHV GH OD
WHPSHUDWXUD HYLWDQGR GH HVWD IRUPD TXH SRU HMHPSOR DOJXQDV PROpFXODV FRPR ODV
SURWHtQDV PX VHQVLEOHV D ORV FDPELRV WpUPLFRV VH DOWHUHQ $Vt VH PDQWLHQH OD
WHPSHUDWXUD FRQVWDQWH )XQFLyQ WHUPRUUHJXODGRUD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-289-320.jpg)
![(OHYDGR FDORU GH YDSRUDFLyQ (O FDORU GH YDSRUL]DFLyQ HV HO TXH VH QHFHVLWD
VXPLQLVWUDU DO DJXD SDUD TXH FDPELH GHO HVWDGR OtTXLGR DO JDVHRVR HYDSRUL]DFLyQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-290-320.jpg)
![3DUD
HOOR HV QHFHVDULR URPSHU ORV SXHQWHV GH KLGUyJHQR SRU OR TXH VH QHFHVLWD VXPLQLVWUDU HO
FDORU VXILFLHQWH SDUD HOOR 'H DKt TXH HO DJXD FDPELH GH HVWDGR D ORV ž (O VXGRU TXH
VHJUHJDQ ORV VHUHV YLYRV SHUPLWH DFXPXODU HO H[FHVR GH FDORU GHO RUJDQLVPR DO
HYDSRUDUVH HOLPLQDUOR FRQ SRFD SpUGLGD GH DJXD DFWXDQGR DVt FRPR UHJXODGRU
WpUPLFR
(OHYDGD WHQVLyQ VXSHUILFLDO /DV PROpFXODV GH OD VXSHUILFLH GHO DJXD
H[SHULPHQWDQ IXHU]DV GH DWUDFFLyQ KDFLD HO LQWHULRU GHO OtTXLGR (VWR IDYRUHFH TXH GLFKD
VXSHUILFLH RSRQJD XQD JUDQ UHVLVWHQFLD D VHU WUDVSDVDGD RULJLQD XQD ³SHOtFXOD
VXSHUILFLDO´ TXH SHUPLWH SRU HMHPSOR HO GHVSOD]DPLHQWR VREUH HOOD GH DOJXQRV
RUJDQLVPRV
'HQVLGDG (O DJXD HQ HVWDGR OtTXLGR HV PDV GHQVD TXH HQ HVWDGR VyOLGR (VWR
SHUPLWH OD YLGD DFXiWLFD HQ FOLPDV IUtRV D TXH DO GHVFHQGHU OD WHPSHUDWXUD VH IRUPD
XQD FDSD GH KLHOR HQ OD VXSHUILFLH TXH IORWD SURWHJH DO DJXD OtTXLGD TXH TXHGD EDMR
HOOD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-291-320.jpg)
![)XQFLRQHV GHO DJXD HQ ORV VHUHV YLYRV
'HULYDQ GH ODV SURSLHGDGHV ItVLFRTXtPLFDV DQWHULRUPHQWH H[SOLFDGDV
)XQFLyQ GH GLVROYHQWH XQLYHUVDO UHODFLRQDGD FRQ VX HVWUXFWXUD GLSRODU
)XQFLyQ HVWUXFWXUDO
)XQFLyQ WUDQVSRUWDGRUD HQ UHODFLyQ WDPELpQ FRQ VX HVWUXFWXUD GLSRODU VX HOHYDGD
IXHU]D GH DGKHVLyQ
)XQFLyQ WHUPRUUHJXODGRUD FRQGLFLRQDGD SRU VX JUDQ FDORU HVSHFtILFR FDORU GH
YDSRUL]DFLyQ
)XQFLyQ DPRUWLJXDGRUD UHODFLRQDGD FRQ OD HOHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV
PROpFXODV
)XQFLyQ UHDFWLYD OR TXH HVWi UHODFLRQDGR FRQ VX HVWUXFWXUD GLSRODU
/26 )/8Ë'26 (1 /26 6(5(6 9,926
(O HVWXGLR GH ODV GLVROXFLRQHV HV IXQGDPHQWDO SDUD FRPSUHQGHU OD PDRU SDUWH GH ORV
SURFHVRV ELROyJLFRV TXH RFXUUHQ HQ HO LQWHULRU GH ORV VHUHV YLYRV
/RV IOXtGRV SUHVHQWHV HQ ORV VHUHV YLYRV FRQVWDQ GH XQD IDVH GLVSHUVDQWH TXH HV DFXRVD
GH XQD IDVH GLVSHUVD R VROXWR IRUPDGD SRU SDUWtFXODV GH SHTXHxR WDPDxR
6HJ~Q HO WDPDxR GH ODV SDUWtFXODV GH OD IDVH GLVSHUVD VH SXHGHQ FODVLILFDU HQ
'LVROXFLRQHV YHUGDGHUDV 6L HO WDPDxR HV LQIHULRU D QP /DV SDUWtFXODV
GLVXHOWDV VRQ LRQHV PROpFXODV DLVODGDV R SHTXHxDV DJUXSDFLRQHV TXH QR VHGLPHQWDQ
'LVSHUVLRQHV FRORLGDOHV 6L HO WDPDxR HVWi HQWUH QP /DV SDUWtFXODV QR
VHGLPHQWDQ SHUR UHIOHMDQ UHIUDFWDQ OD OX] TXH LQFLGH VREUH HOODV
8Q GH ORV SURFHVRV ItVLFRTXtPLFRV PiV LPSRUWDQWHV TXH WLHQHQ OXJDU HQ ODV GLVROXFLRQHV
YHUGDGHUDV HV OD yVPRVLV
Ï6026,6
/D yVPRVLV HV XQ SURFHVR ItVLFRTXtPLFR FRQVLVWHQWH HQ HO SDVR GHO GLVROYHQWH GH XQD
GLVROXFLyQ QR GHO VROXWR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-292-320.jpg)
![D WUDYpV GH XQD PHPEUDQD VHPLSHUPHDEOH (O SDVR GHO
GLVROYHQWH VH UHDOL]D VLHPSUH GHVGH OD VROXFLyQ PiV GLOXtGD KLSRWyQLFD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-293-320.jpg)




![x /$6 6$/(6 0,1(5$/(6
/DV VDOHV PLQHUDOHV VH SXHGHQ HQFRQWUDU HQ ORV VHUHV YLYRV HQ WUHV IRUPDV
6XVWDQFLDV PLQHUDOHV SUHFLSLWDGDV FRQVWLWXHQ HVWUXFWXUDV VyOLGDV LQVROXEOHV
FRQ QDWXUDOH]D HVTXHOpWLFD IRUPDQGR WDQWR H[RHVTXHOHWRV FRPR HQGRHVTXHOHWRV 3RU
HMHPSOR HO FDUERQDWR GH FDOFLR IRVIDWR GH FDOFLR OD VtOLFH HWF
6DOHV PLQHUDOHV GLVXHOWDV /DV VXVWDQFLDV PLQHUDOHV DO GLVROYHUVH HQ HO PHGLR
LQWHUQR DFXRVR GDQ OXJDU D DQLRQHV FDWLRQHV (VWRV LRQHV PDQWLHQHQ FRQVWDQWH HO JUDGR
GH VDOLQLGDG GHQWUR GHO RUJDQLVPR DXGDQ D PDQWHQHU HO JUDGR GH DFLGH] S+](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-298-320.jpg)
![OR TXH
HV LPSUHVFLQGLEOH SDUD HO FRUUHFWR GHVDUUROOR GH ODV UHDFFLRQHV PHWDEyOLFDV FHOXODUHV (O
PHGLR LQWHUQR GH ORV RUJDQLVPRV SUHVHQWD XQDV FRQFHQWUDFLRQHV LyQLFDV FRQVWDQWHV GH
KHFKR FXDOTXLHU YDULDFLyQ SURYRFD DOWHUDFLRQHV LPSRUWDQWHV HQ OD GLQiPLFD FHOXODU /D
PDRU R PHQRU SUHVHQFLD GH VDOHV HQ HO PHGLR LQWHUQR FHOXODU GHWHUPLQD TXH VH
SURGX]FDQ IHQyPHQRV RVPyWLFRV TXH UHJXOHQ ODV FRQFHQWUDFLRQHV D DPERV ODGRV GH OD
PHPEUDQD FHOXODU FRQ OR TXH VH UHJXOD OD SUHVLyQ RVPyWLFD HO YROXPHQ FHOXODU
3DUD HYLWDU ODV YDULDFLRQHV GH S+ TXH FDXVDUtDQ WUDVWRUQRV JUDYHV HQ DOJXQRV
SURFHVRV PHWDEyOLFRV OD SpUGLGD GH OD FDSDFLGDG IXQFLRQDO GH PXFKDV HQ]LPDV
DOJXQDV VDOHV PLQHUDOHV GLVXHOWDV FXPSOHQ HVWD IXQFLyQ IRUPDQGR GLVROXFLRQHV WDPSyQ
R DPRUWLJXDGRUDV TXH FRPSHQVDQ HO H[FHVR R HO GpILFLW GH LRQHV HQ HO PHGLR
PDQWHQLHQGR FRQVWDQWH HO S+ (VWDV GLVROXFLRQHV HVWiQ IRUPDGDV SRU XQ iFLGR GpELO VX
EDVH FRQMXJDGD TXH DFW~DQ FRPR GDGRUHV R UHFHSWRUHV GH + UHJXODQGR DVt HO S+ D
TXH HO S+ ORJ +](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-299-320.jpg)
![8Q HMHPSOR HV HO VLVWHPD WDPSyQ IRVIDWR
+32 +32 +
6DOHV PLQHUDOHV
DVRFLDGDV D PROpFXODV
RUJiQLFDV QRUPDOPHQWH
DSDUHFHQ DVRFLDGDV D SURWHtQDV R OtSLGRV
6H UHFRPLHQGD FRQVXOWDU
KWWSZZZRXWXEHFRPZDWFKY 82Z%ZF/$ IHDWXUH UHODWHG
$FLGLILFD
1HXWUDOL]D](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-300-320.jpg)






































































































































































































































