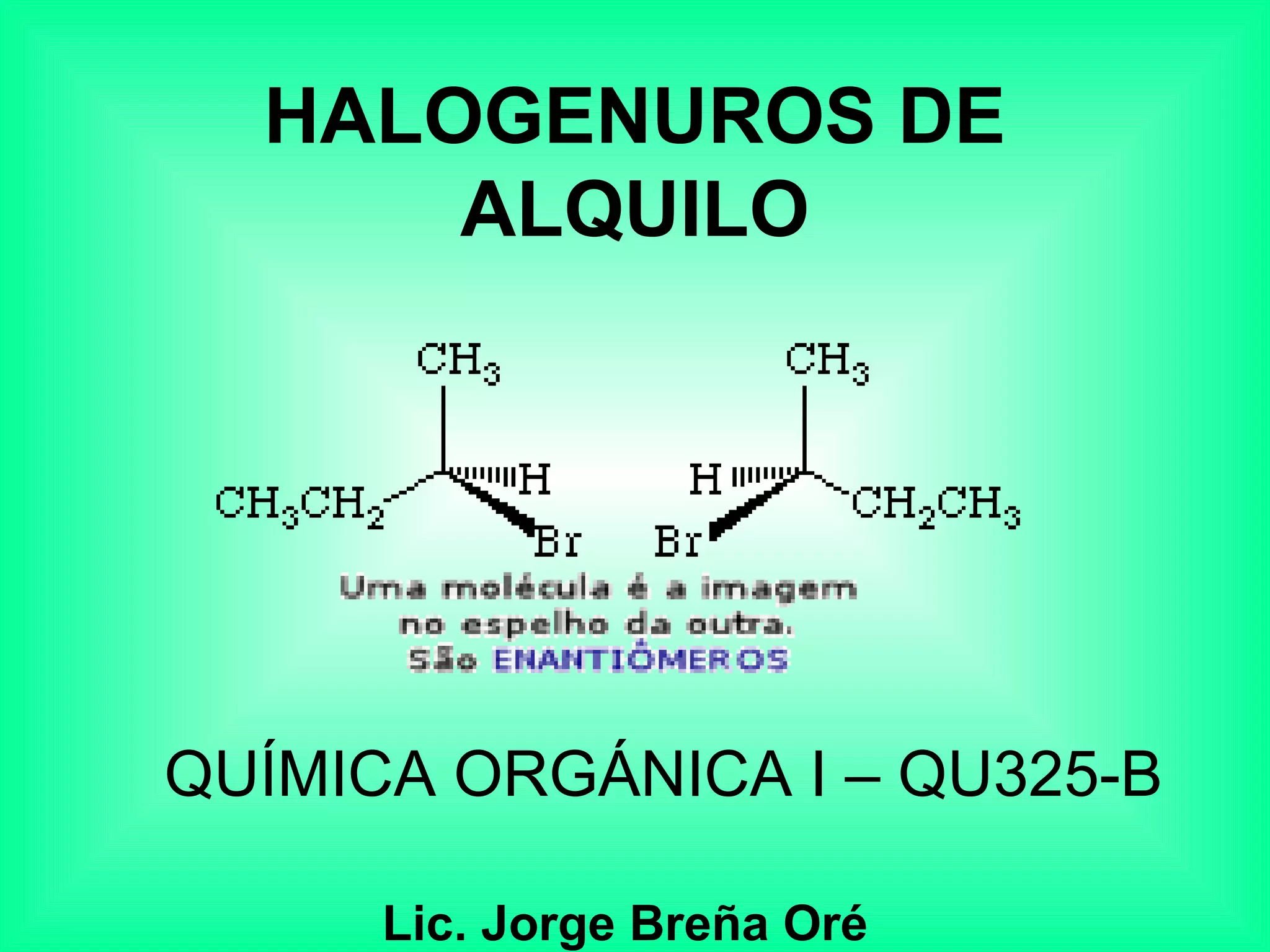
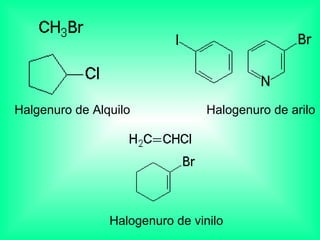
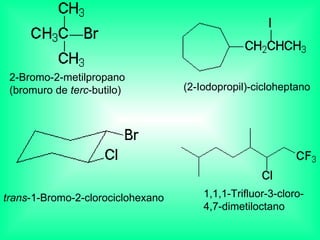
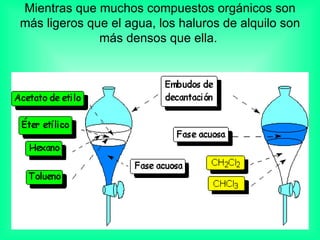
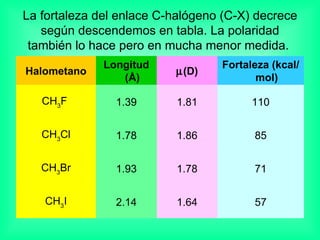
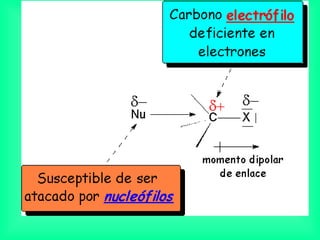
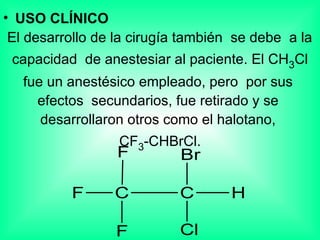
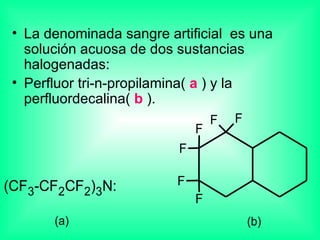
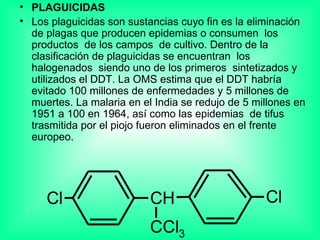
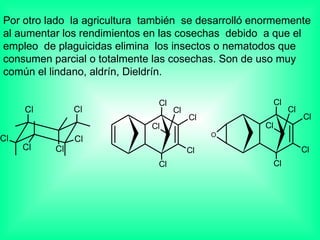
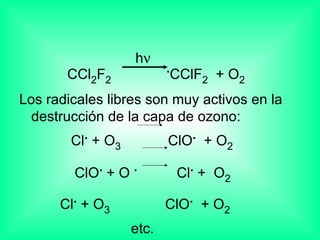
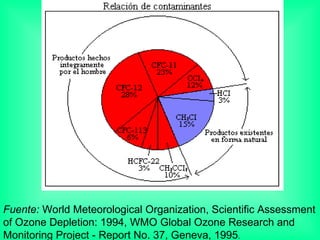
Este documento trata sobre los haluros de alquilo, compuestos orgánicos que contienen un halógeno unido a un carbono. Explica su nomenclatura, propiedades físicas, y usos importantes como solventes, refrigerantes, plaguicidas e insecticidas. También describe cómo los clorofluorocarbonos destruyen la capa de ozono al liberar átomos de cloro que catalizan su descomposición.