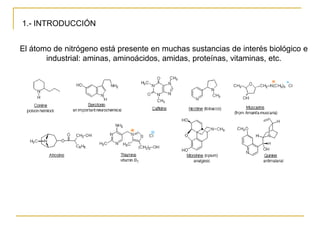
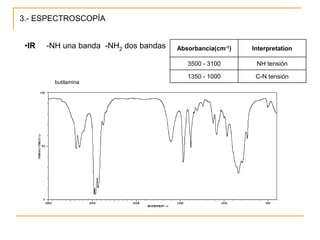
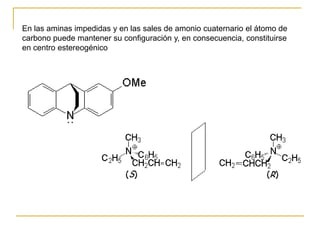
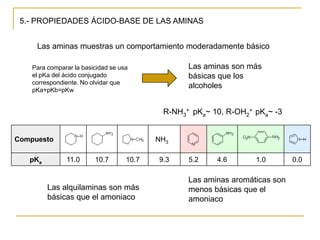
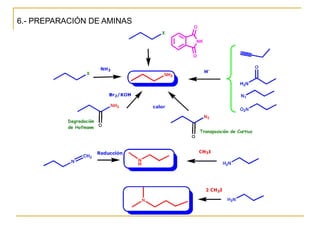
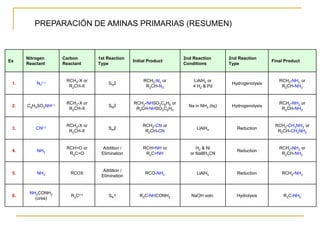
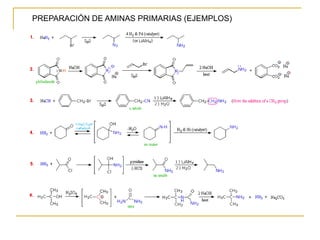
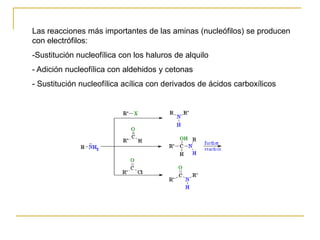
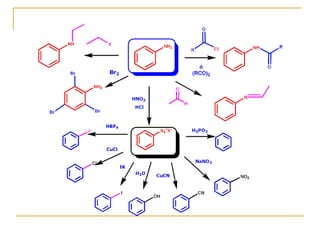
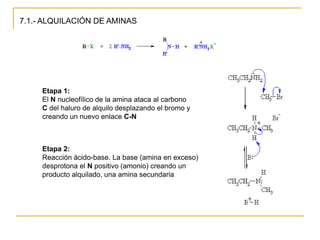
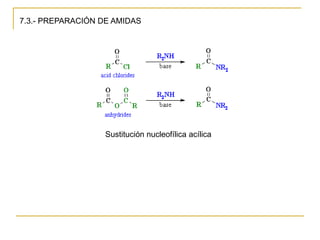
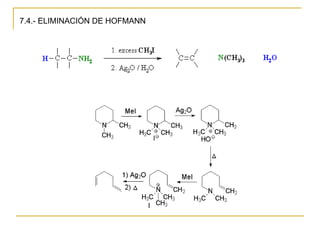
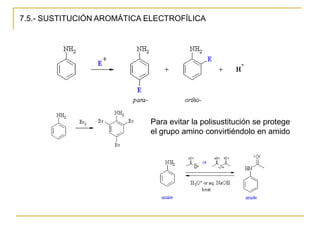
Las aminas se pueden preparar de varias maneras:
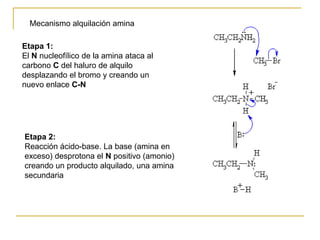
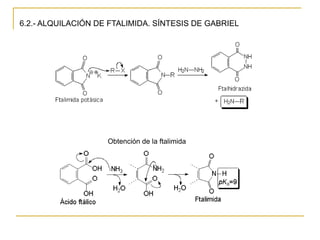
1) Alquilación de amoníaco o aminas con haluros de alquilo produce aminas primarias o secundarias.
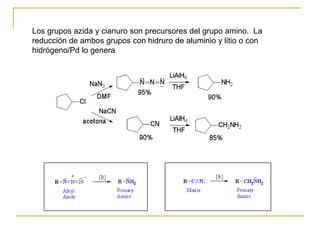
2) Reducción de grupos funcionales más oxidados como nitrilos, nitrocompuestos, azidas o amidas genera aminas.
3) Aminación reductiva de aldehídos y cetonas a través de la formación y reducción de iminas intermedias también produce aminas.