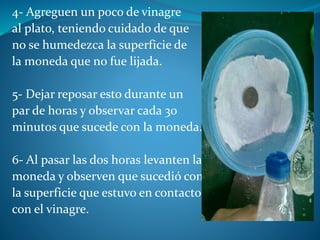
El documento habla sobre la galvanoplastia, que es la aplicación tecnológica de la deposición mediante electricidad. Se basa en transferir iones metálicos de un ánodo a un cátodo a través de una solución acuosa, depositándolos en el cátodo. Inicialmente se usó para reproducir objetos de metal de forma exacta para impresión, pero ahora también se usa en mecánica de precisión donde se deposita metal sobre un sustrato que luego se elimina, dejando solo el metal depositado.