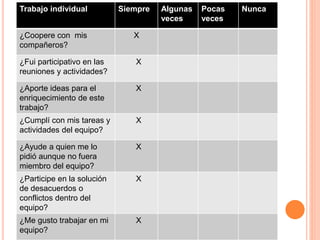
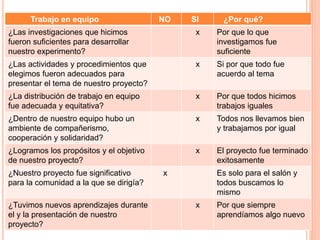
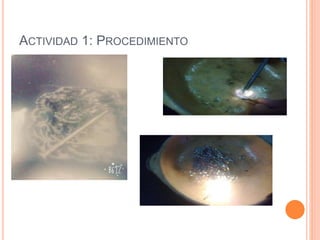
El documento describe tres actividades para estudiar la corrosión. La primera actividad muestra cómo se oxidan un clavo y lana de acero al exponerlos al fuego. La segunda actividad observa cómo se oxida un codo de cobre al ponerlo en vinagre. La tercera actividad produce reacciones al dejar caer limaduras metálicas sobre una vela encendida. El documento concluye que las reacciones ocurrieron debido a la presencia de oxígeno y que la oxidación y corrosión son los procesos involucrados.
















![ La piel: Entre los principales signos que evidencian el
paso de los años, se encuentra el deterioro de la piel, la
cual pierde elasticidad, le aparecen manchas y también
arrugas.
Todas éstas manifestaciones “vienen de adentro”, es
decir suceden justo debajo de la piel, ya que con los
años la grasa interna tiende a diluirse, (se produce en
menos cantidad) trayendo como consecuencia que la
dermis literalmente se hunda provocando arrugas,
debido a la perdida del colágeno y elastina que como su
nombre lo indica, controlan la elasticidad.
El cabello (las canas): Otro signo de envejecimiento que
está asociado con la melanina de manera directa, es la
decoloración del cabello mejor conocida como “canas”.
La aparición de éstas, se debe a que con el tiempo el
pigmento (melanina) que se encuentra en la raíz de
cabello [folículo piloso] va disminuyendo su capacidad
de producción y como resultado de este “deterioro” el
cabello crece “sin color” mostrando una apariencia
blanca.](https://image.slidesharecdn.com/proyecto4-150410155243-conversion-gate01/85/Proyecto-4-Como-evitar-la-corrosion-18-320.jpg)