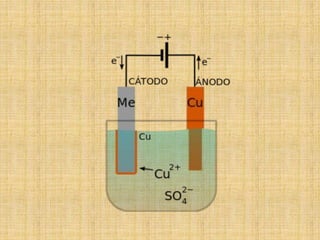
El documento describe los métodos para evitar la corrosión. Explica que la corrosión es el deterioro de un material debido a un ataque electroquímico por su entorno. Luego detalla cinco métodos para controlar la corrosión: 1) eliminar elementos corrosivos, 2) utilizar materiales más resistentes, 3) protección eléctrica, 4) usar barreras entre el material y los elementos corrosivos, y 5) sobredimensionar las estructuras.