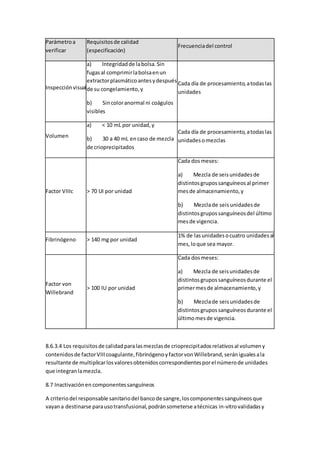
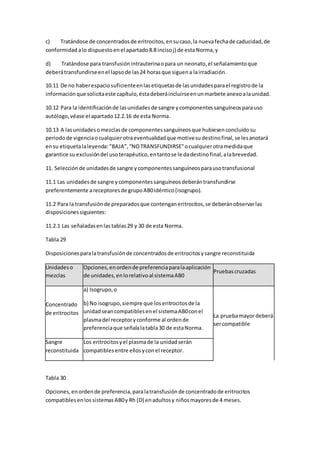
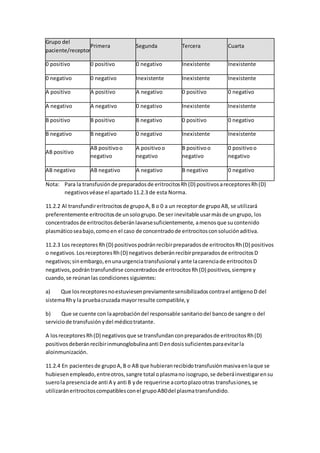
Este documento describe la atención de enfermería para niños con cáncer. Explica que la enfermería oncológica pediátrica ha permitido mejorar los resultados del tratamiento del cáncer infantil. Detalla los cuidados de enfermería necesarios desde la preparación para la quimioterapia hasta el apoyo en etapas avanzadas de la enfermedad, incluyendo el manejo de complicaciones comunes. Resalta la importancia de brindar una atención integral al niño con cáncer y su familia durante todo el proceso de la




![http://academico.upv.cl/doctos/ENFE-6018/%7BA0B052D8-B08B-4327-BB52-
0A7BE4F1F7F0%7D/2012/S1/10_enfermeria_oncologica.pdf
RevistaPediatríaElectrónicaUniversidadde Chile ServicioSaludMetropolitanoNorte Facultad
de MedicinaHospital Clínicode NiñosDepartamentode PediatríayCirugíaInfantil RobertoDel
Río Rev.Ped.Elec.[enlínea] 2005, Vol 2, N° 2. ISSN 0718-0918 37 ACTUALIZACIÓN Atenciónde
enfermeríaenel niñoconcáncer E.U. CheryPalma,E.U FannySepúlvedaUnidadde Hemato-
Oncología,Hospital de NiñosDr.Robertodel Río. ResumenLaoncologíainfantil representaun
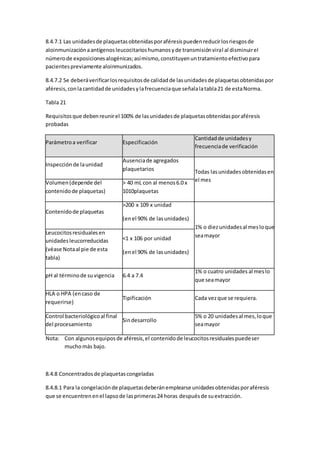
desafíopara el equipode salud.El desarrollode enfermerasespecializadasenlaatenciónde
estospacienteshapermitidoungranavance enlosresultadosde sobrevida.Laatenciónde
enfermeríaesfundamental parael manejode lasfrecuentescomplicacionesque se presentan
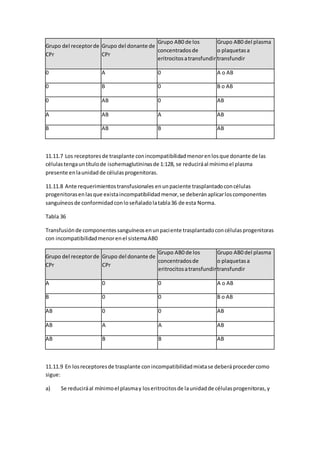
como consecuenciade lostratamientos.Se detallalaatencióndel pacienteoncológico,desde
la preparaciónde laquimioterapiahastaloscuidadosde piel ymucosasyel acompañamiento
enetapasavanzadasde laenfermedadoncológica.Palabrasclave:Enfermeríaoncológica,
quimioterapia,cuidadospaliativos.IntroducciónEl cáncerhaexperimentadounaumentoen
su frecuenciaenlosúltimosañosanivel de lapoblacióngeneralyestotambiénafectaalos
niños.Losmenoresde 15 añosse venafectadosporun considerablenúmerode neoplasiasy,
esasí como el cáncerinfantil hapasadoa constituirunproblemade saludpública,enla
medidaque hansidomejoradoslos métodosdiagnósticosycontroladasotraspatologíascomo
lasinfecciosas.(1) Cuandoel afectadoporestaenfermedadesunniñose alterael
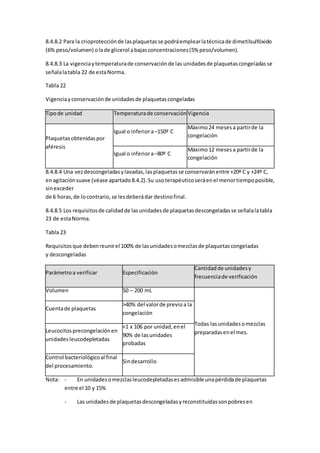
funcionamientofamiliaryel de la comunidadala que pertenece,puestodossonsensiblesal
sufrimientode unniño.Ocurrenlargasy frecuenteshospitalizaciones,largostratamientoscon
la consiguiente ansiedad,depresión,sentimientosde soledadporlaconstante separaciónde la
familia,cambiosfísicose inmunitarios,retrasoenel desarrollopsicomotoryescolar. El
desarrollode laenfermeríahapermitidoungranavance enla especialidadoncológicayun
real aporte a laprevención,detección,diagnóstico,tratamientoymonitorizacióndelcáncer.
Este artículo reflejalaexperienciade enfermeraspediátricasdedicadasalaoncologíay la
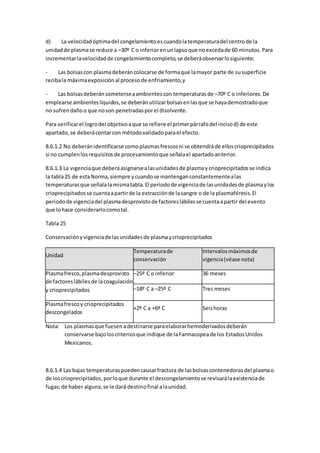
revisiónde bibliografíaenestaárea.Intentabrindarlasrecomendacionesgeneralespara
otorgar la atenciónintegral de enfermeríaque todoniñoconcáncer debe recibir,
independientementede que si estáhospitalizadoonoenuna unidadoncológica.El propósito
de este trabajoes invitaral equipode saludaconsultareste artículoe implementarlos
aspectosrelevantesenlaatencióndel niñoconcáncer,y por supuestoinvitaratodosaquellos
que no conocenlaoncología infantil,yenespecial alasfuturasgeneraciones,aperderel
miedode tratar con losmaravillososycomplejosniñosoncológicos.Antecedentes
epidemiológicosEl cáncerinfantil derivaprincipalmente de tejidosembrionariosconunaalta
capacidadproliferativa,loque hace que porun ladoseanmuy agresivosyal diagnóstico
habitualmente se encuentrenenetapasavanzadas,peroporotroladoseanaltamente
sensiblesaquimioyradioterapia,haciendoposiblelacuraciónenmás del 60% de loscasos
(2,3) TenemosenChile 517 casosnuevosde cáncer infantil poraño,siendolaleucemia,los
RevistaPediatríaElectrónicaUniversidadde Chile ServicioSaludMetropolitanoNorte Facultad
de MedicinaHospital Clínicode NiñosDepartamentode PediatríayCirugíaInfantil RobertoDel
Río Rev.Ped.Elec.[enlínea] 2005, Vol 2, N° 2. ISSN 0718-0918 38 linfomasylostumoresde
sistemanerviosocentral laspatologíasmásfrecuentes.(4) El programaintegral Programa
Infantil de DrogasAntineoplásicas(PINDA) esunprogramanacional de detección,tratamiento](https://image.slidesharecdn.com/leucemia-150617011455-lva1-app6892/85/Leucemia-5-320.jpg)

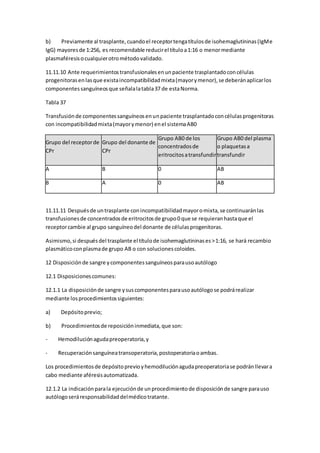
![Puede serrealizadaconfinesdiagnósticos,terapéuticosopaliativos.(6) RevistaPediatría
ElectrónicaUniversidadde Chile ServicioSaludMetropolitanoNorte Facultadde Medicina
Hospital Clínicode NiñosDepartamentode PediatríayCirugíaInfantil RobertoDel RíoRev.
Ped.Elec.[enlínea] 2005, Vol 2, N° 2. ISSN 0718-0918 39 D)Transplante de médulaósea:Esla
infusiónde precursoreshematopoyéticos,conel finde rescataral paciente de laaplasia
medularque se produce despuésde administrarterapiasde granintensidad.Existen2tipos
principalesdependiendode lafuente de precursoreshematopoyéticos:AlogénicoyAutólogo.
(6) QuimioterapiaAspectosgeneralesde bioseguridad.(2) Lasdrogas antineoplásicassonun
riesgoocupacional porsugenotoxicidad,carcinogenicidad,teratogenicidadytoxicidad
orgánica.El manipuladorpuede absorberloscitostáticospordiferentesvías:•Respiratoria:
manipulaciónproduce aerosoles,vapores,neblinas.•Piel ymucosas:contactodirectoa nivel
de mucosas.• Parenteral:pinchazos,cortopunzante•Oral: ingestadescuidadaoaccidental de
alimentoscontaminados.Losefectospormanipulaciónde quimioterapiapuedenserlocales
como: dermatitis,mucositis,pigmentación,reaccionesalérgicas,hipoacusiaosistémicos
como: náuseas,vómitos,vértigos,cefaleas,mareos,alopecia,prurito,neutropenia.
Preparaciónyadministraciónde quimioterapia(7) Debe serpreparadaporEnfermerao
QuímicoFarmacéuticocapacitadoscientíficaytécnicamente paraello.Esadministradapor
enfermerascapacitadas.Se debe prepararbajounacampanade bioseguridadubicadaenun
recintocentral exclusivo,concirculaciónrestringida.Al prepararlaquimioterapiael operador
debe protegerse conmaterial desechable:guantes,anteojos,mascarillas,delantal manga
larga,pecherade hule.Nodebenmanipularcitostáticos:•Mujeresembarazadasoenperíodo
de lactancia.• Personasque esténrecibiendoohayanrecibidoquimioterapia.•Madresde
hijosconmalformaciones.•Personal consospechade dañogenético.•Personal consospecha
de inmunodeficiencias.¿Qué sonloscuidadospaliativos?Enestaetapala enfermeratambién
juegaun rol importante ydebe saberque pese alosavancesalcanzadosenoncología,un
númerode niñosfallecerán.Frente aestasituacióndebe sercompasivayhumana,debe
aprendera trabajaren equipoconel paciente fuerade alcance médico,debeparaelloconocer
sus limitaciones,debilidadesyfortalezas.Debe reflexionaracercade 2 preguntasenel que
hacer profesional:¿Estamospreparadosparaenfrentarlapartidade nuestrospacientes?,
¿Cuándohablarde la muerte con losniños?Enla actualidadexiste unprogramaministerialde
aliviodel dolorycuidadospaliativosque se definencomola“Asistenciatotal yactivadel
paciente fuerade alcance médico,noprolonganlavidani evitanlamuerte,suúnicofines
evitarel sufrimientoyayudaral paciente a obtenerlamejorcalidadde vida,que él deseayle
esposible ensusúltimosdíasde vida”(8).Nunca debemosolvidarque unniñoocualquierser
humano,independiente de suraza,edad,condiciónsocioeconómicatiene derechoa:•
“Recibiratencióndel personal de salud,aunque seaevidente que novaa sanar” • “Sertratado
como serhumano hasta el final de susdías”. (9) Plande atenciónde enfermería(10) Al
atenderunniñocon cáncer se debe tenerenconsideraciónque esunniñoyunafamiliaque
son sometidosalargosycomplejotratamientos,que manejanmuchainformaciónacercade su
patologíade base y tratamientoyque RevistaPediatríaElectrónicaUniversidadde Chile
ServicioSaludMetropolitanoNorte Facultadde MedicinaHospitalClínicode Niños
Departamentode PediatríayCirugíaInfantil RobertoDel RíoRev.Ped.Elec.[enlínea] 2005,
Vol 2, N° 2. ISSN 0718-0918 40 por logeneral estánacostumbradosauna relacióndirecta,
estrechay francacon su equipomédicoyde enfermeríatratante.Lavidadel niñoyla
dinámicafamiliarse hanvistoalteradasbruscayrápidamente,sonniños yfamiliasque se](https://image.slidesharecdn.com/leucemia-150617011455-lva1-app6892/85/Leucemia-7-320.jpg)
![debieronadaptaranuevaspersonasque lesdicencomoactuar,que comer,que hacer,donde
trasladarse a vivir,etc.La enfermeraque enfrentaestospacientesdebe estarenconstante
capacitación,que le permitacontarcon lasmejoresherramientasparaatendera este paciente
demandante de asistenciafísicayemocional.¿Qué se debe valoraral atenderaunniñocon
cáncer? (2, 9) 1. Edad – cicloevolutivo.2.Sexo.3.Familia,funcionamiento.¿Cómose ve
alteradaal tenerunhijocon cáncer?¿Necesitanlospadresque trabajanapoyopsiquiátricoy
tal vezunalicenciamédicaparapoderbrindaruna atencióndirectaasu hijo?¿Quiénse hace
cargo del niño?La madre o la abuelao tal vezotra persona.¿Estánviviendounduelo
anticipado?4.Cuidadde origen.¿Estánen lacuidaddonde vivenhabitualmente ofueron
derivadosaun centroPINDA?¿Tienendonde alojar?5.Estudiosdel niñoylospadrespara
programar un plande educaciónencuidadosdel niñoconcáncer.Escolaridaddel niño:¿Le
permitirásutratamientocontinuarsusestudiosenformanormal odebe serderivadoauna
escuelahospitalaria?6.Redesde apoyoconla cuentael niñoy su familia,asícomotambién
losfactoresencontra. 7. Religiónyasistenciaespiritual.8.Patologíaoncológicade base,
estadiode laenfermedad,riesgode presentarunaurgenciaoncológica,evaluación
cardiológica.9.Evaluacióndel doloral diagnósticoydurante todala evolución.10.Preparación
y asistenciaenexámenesde laboratorio.11.Examenfísico, presenciade lesiones,equimosis,
sitiosde infecciónrealesypotenciales.12.Accesosvenosos,¿Tiene el niñounaccesovenoso
adecuadopara su tratamiento?¿Se puede manejarconunavía periféricaoesnecesarioun
acceso venosocentral transitorioopermanente?13.Complicacionesde lapatologíade base o
del tratamiento.14.Urgenciasque se puedenpresentarenel niñooncológico:hemorragias,
shockcardiogénico,séptico,anafiláctico,síndrome de lisistumoral,síndromede venacava
superior,reaccionestransfusionales,obstrucciónintestinal,compresiónmedular,
hipercalcemia,etc.15. Tratamiento,enque etapadel tratamientoestáel niño:quimioterapia,
radioterapia.¿Serásometidoaunacirugía? ¿Irá a transplante de médulaósea?o¿Estáen
cuidadospaliativos?16.Evoluciónbiopsicosocial.¿Cómohasidoel procesode adaptacióndel
niñoy su familiaal tratamiento?¿Enqué medidaycómose han adaptadoa los cambiosenla
vidadiaria?17. En sí misma,¿qué fortalezasydebilidadestiene ustedcomo profesional de
enfermeríaparaenfrentaraeste niñoy sufamilia?Diagnósticospotencialesdel niño
oncológico• Alteraciónde ladinámicafamiliarasociadoal diagnósticode cáncer.Estopuede
manifestarse porllanto,angustia,labilidademocional,inquietudy/oagresividadtantodel
niño,lamadre u otro miembrode lafamilia.•Alteracióndel estadoemocional delniño
relacionadoconlahospitalizaciónysucondiciónde enfermo,manifestadopornegación,
ansiedad,labilidademocional,llanto,angustia y/oagresividadcadavezque algúnmiembrodel
equipoingresaalasala para controlarlooexaminarloymásaún sinoessu equipomédico
habitual.Estoocurre cuando el niñose hospitalizaenunaunidaddiferente alaoncológica.•
Riesgopotencial de sepsisenrelaciónal episodiode neutropeniaoinfecciónque acompaña
generalmente al debutde lapatologíaoncológica.•Riesgopotencial de presentarotras
alteracionesque acompañanalapatología oncológicatalescomomucositis,tiflitis,
hemorragia,dolor,yriesgode presentarlascomplicacionespropiasde cadaunade ellas.•
Riesgode desarrollaralgunaurgenciaoncológicacomolisistumoral,shockséptico,
hemorragia,obstrucciónintestinal,compresiónmedular,síndrome de venacava,
hipercalcemia.RevistaPediatríaElectrónicaUniversidadde Chile ServicioSaludMetropolitano
Norte Facultadde MedicinaHospital Clínicode NiñosDepartamentode PediatríayCirugía
Infantil RobertoDel RíoRev.Ped.Elec.[enlínea] 2005, Vol 2, N°2. ISSN 0718-0918 41 •](https://image.slidesharecdn.com/leucemia-150617011455-lva1-app6892/85/Leucemia-8-320.jpg)
![Alteracióndel bienestardel niñorelacionadoconel dolorque le provocanlapatologíade base
y/oprocedimientosdiagnósticos.Estopuede sermanifestadoporcambiosenlafacie del niño,
quejidos,llanto,irritabilidad,oatoníapsicomotrizyposturas viciosas.•Riesgode deteriorode
la nutriciónyla hidrataciónrelacionadoconlasnáuseas,vómitos,anorexia,mucositisy/o
gastritis,que le provocanlasdrogasantineoplásicas.•Temordel niñoy lamadre enrelacióna
losefectosadversosdel tratamientoya laspuncionesvenosas.•Riesgode efectosadversos
hematológicosenrelaciónal usocombinadode agentesantineoplásicos.•Riesgopotencial de
presentarreaccionesalérgicasdurante laadministraciónde laquimioterapia(fiebre,
enrojecimiento, rushcutáneo,dolorlocal,pruritolocal ogeneralizado,disnea,hipotensión).•
Riesgopotencial de alteraciónde laimagencorporal del niñoenrelaciónalaalopecia,
oscurecimientode lapiel,fascie de luna(porel usode corticoides),marcasde laradioterapia,
etc.• Temordel niñoy la madre enrelaciónal tratamientoconradioterapia,ala cirugía o al
transplante de médulaósea,esdecir,temoralodesconocido.•Temorde lamadre a que el
niñopierdael añoescolar.• Riesgopotencial de quedar fuerade alcance médicoenrelacióna
la evoluciónde laenfermedadyrespuestaatratamiento,haciendonecesarialaintegracióndel
paciente ysu familiaaunprograma de aliviode dolorycuidadospaliativos.Objetivosde la
atenciónde enfermería•Reducirlaansiedadyla negación.• Reducirestadodepresivoy
temor.• Promovery favorecerexpresiónde sentimientos.•Favorecerlaadherenciaal
tratamiento.•Favorecerla comunicaciónyrelaciónfamiliar.•Lograr la organizaciónfamiliar
para una mejoratencióndel niño.•Reduciryevitarel riesgode infección.•Pesquisar
oportunamente signosysíntomasde infeccióny/ocomplicaciones.•Evitar hemorragias.•
Educar al paciente y/ofamiliarresponsable paralapesquisade complicacionesylaconsulta
precozfrente a laapariciónde ellas.• Evitarla angustiaque provocalo desconocido.•Evitarel
dolor.• Evitar la deshidrataciónporhiperemesis.•Evitarlasnáuseasy losvómitos.•
Mantenero mejorarel estadonutricional del niño.•Estimularel apetito.•Favorecerla
adaptacióndel niñoal cambiode imagencorporal.Actividadesdesarrolladasporenfermería•
Terapiaindividual:ademásde comunicaral niñoel tratamientoaseguir,losefectosesperados,
decirle que noestarásoloy brindarapoyoreligioso.Primeroevaluarloque sabe el niño,ya
partir de ahí, responderentérminossimplesloque el niñoquierasaber.•Administraciónde
antidepresivosporhorario,si esnecesario,segúnindicaciónmédica.•Tallerfamiliar:donde se
analicenlosproblemasque hatenidocadamiembrode lafamiliaparaatenderal niño,
brindarlesorientaciónde cómomejorarlaatención,(comoporejemplosistemasde turnos
que permitanatenderal niño,llevarloaloscontroles,sesionesde quimioterapiayala vez,no
descuidara losdemásmiembrosde lafamilia).Sugerirlesdistracción,recordarlesque ellos
necesitancomerydormir.• Informara lafamiliaenque consiste el tratamiento,asícomode
losefectosadversosde éste.•Examenfísicoperiódicoenbuscade signosde deteriorofísico,
deshidratación,hemorragias,mucositisuotracomplicación.•Toma y evaluaciónde
hemogramaantesde cada ciclode quimioterapia.•Lavadode manos antesy despuésde
atendera cada paciente.•Cambiode circuitosendovenosos,técnicasde aislamiento,
curaciones,etc.segúnnormade cada centro hospitalario.•Educaral niñoy la madre o
cuidadorcomo examinarel cuerpoenbuscade palidez,signoshemorrágicosoinfecciones
locales.•Enseñarlesque debenevitarlosjuegos bruscos,caídas,golpessi tieneunrecuento
de plaquetasbajo,que hacerencaso de hemorragias,asíRevistaPediatríaElectrónica
Universidadde Chile ServicioSaludMetropolitanoNorte Facultadde MedicinaHospital Clínico
de NiñosDepartamentode PediatríayCirugíaInfantil RobertoDel RíoRev.Ped.Elec.[enlínea]](https://image.slidesharecdn.com/leucemia-150617011455-lva1-app6892/85/Leucemia-9-320.jpg)
![2005, Vol 2, N° 2. ISSN 0718-0918 42 comotambiénlaexposiciónapersonasresfriadas,niños
con infecciones,animalesdomésticos.•Transfusiónde hemoderivadossegúnindicación
médica.• Administraciónde alimentaciónfraccionada,enteral y/oparenteral segúnindicación
médica.• Control seriadode pesoyevaluaciónpornutricionista•Educacióna lamadre y al
niñosobre ingestiónde alimentos:beberlíquidosabundantesyfraccionados,al igual que
alimentosblandos,fríos,sinaliños,segúnel agradodel niño,noforzarlaalimentaciónporel
contrarioaprovecharlosperiodosde apetenciaparadarle alimentosde altovalornutritivo.•
Administraciónde antieméticossegúnindicaciónmédica,porhorarioysegúnesquemade
quimiooradioterapia.•Aseobucal diariocon cepillode cerdassuavesoalgodónhúmedocon
agua bicarbonatada,colutoriosconantisépticobucal despuésde cadaalimentaciónocada4
horas si estácon régimenceroo no quiere comer,usode anestésicoslocalesSOS,colutorios
con aloe vera.• Baño diarioencama o enducha.En inviernoevitarademáslascorrientesde
aire.• Contestarenforma clara, breve ysimple todaslaspreguntasque el niñoylamadre
hagan respectoal tratamientoyprocedimientos.•Coordinarlainstalaciónde uncatéter
venosocentral,si el paciente porsuscaracterísticaso patologíade base lonecesita,coordinar
la colocaciónde éste enpabellónyeducaciónal niñoylamadre acerca de loscuidadosdel
mismo,Si ustednolosconoce o maneja,derive al niñoysumadre a la enfermerade oncología
de su hospital.•Control de signosvitalesysupervisióndel paciente yvíavenosadurante la
administraciónde quimioterapia.•Educaciónacerca de cómo manejarloscambiosde imagen
corporal,uso de pelucas,pañuelos,ropacómoda,holgada,explicarle que loscambiosde
imagensontransitorios.•Coordinarlaasistenciaaclasescon la escuelaoncológicade cada
centrohospitalarioolaescuelahabitual.•Administraciónde analgesiasegúnhorario,
evaluaciónperiódicade dolor.•Coordinaciónyderivaciónaequipode cuidadospaliativos.
Evaluaciónde lasaccionesde enfermeríaEl niño,lamadre y el padre se encuentranmás
tranquilos,aceptanel tratamientoaseguiryparticipanactivamentede él.Trabajanconsus
redesde apoyodesarrollandounbuenprocesode adaptaciónal cambio,evolucionan
favorablemente duranteel tratamientosingrandesincidentes.Confíanensuequipomédico
tratante.Comentariosy ConclusionesCreemosque todoel personalque atiende aniñoscon
cáncer debe recibirunaformaciónespecial,yaque noesfácil trabajar con este tipode
pacientes.Peroconstituyenungrandesafíoyademáspermitendesarrollarlaenfermeríaen
todassus potencialidadeshumanasyprofesionales,ademásesindispensable que todoel
personal este consciente de todoslosriesgos(biológicosysicológicos)alosque se expone al
trabajar enun serviciode oncología.Nuncase debe olvidarque pese aque hemossido
formadospara salvarvidas,durante nuestroquehacerprofesional nosveremosenfrentadosa
la muerte comoparte de lavida,independientementede laespecialidadque desarrollemos.
Por lotanto esnuestrodeberprofesional dignificarlamuerte yhacer que nuestrospacientes
lleguenaellasindolorni sufrimiento,esdecir,beneficiaral paciente fuerade alcance
terapéuticoconloscuidadospaliativosque sucondiciónde serhumanomerece.Referencias.
1. Cáncer Infantil enChile.MINSAL1999. 2. Norma Cuidadosenfermeríaparael niñocon
cáncer. MINSAL2005. 3. Cameron,R. “Oncologíapráctica”. España,Editorial Médica
Panamericana,1995: 1-4, 10- 18. 4. Burotto,M. etal. “Manual de enfermeríaoncológica
pediátrica”,1991; Editorial médicapanamericana,España.5.Arraztoa,J.”Cáncer,diagnósticoy
tratamiento”.Chile,Editorial Mediterráneo,1997. RevistaPediatríaElectrónicaUniversidadde
Chile ServicioSaludMetropolitanoNorte Facultadde MedicinaHospital Clínicode Niños
Departamentode PediatríayCirugíaInfantil RobertoDel RíoRev.Ped.Elec.[enlínea] 2005,](https://image.slidesharecdn.com/leucemia-150617011455-lva1-app6892/85/Leucemia-10-320.jpg)






































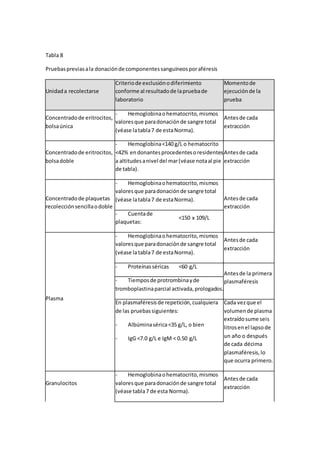
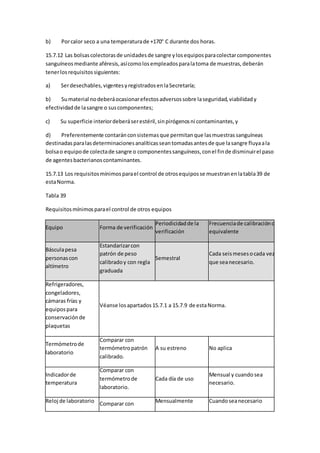
![6.10.5.6 Las personasque tenganantecedentesclínicosode laboratoriode lasenfermedades
siguientes:
a) Leishmaniasisvisceraloenfermedadde Kala-Azar;
b) Babesiosis;
c) Meningitisyencefalitiscrónicasocasionadasporbacilosácidoalcohol resistentes,
criptococo,toxoplasmaylasproducidasporviruslentos;
d) Fiebre Qcrónica,y
e) Retrovirus,talescomo:HTLV-I,HTLV-II.
6.10.5.7 Las personasque requierencontinuamente transfusiones,talescomolosque padecen
hemofiliauotrostrastornoshemorrágicos,asícomo losproveedoresoexproveedores
remuneradosde sangre oplasma.
6.10.5.8 Las personasque tenganantecedente opadezcancualquierneoplasia,salvocánceres
localizadosycompletamente curados[véase el incisoa) del apartado6.10.6.3.1 contenidoen
la tabla4 de estaNorma].
6.10.5.9 Las personasque tenganantecedentesopadezcancualquierade lasenfermedades
cardiovascularesque se indicanacontinuación:
a) Infartoal miocardio;
b) Trombosisarterial ovenosarecurrente;
c) Esclerosisde lascoronarias;
d) Anginainestable;
e) Hipertrofiaaórtica;
f) Arritmias;
g) Fiebre reumáticaque hubiese dejadosecuelascrónicas,y
h) Historiasugestivade retenciónhídrica,cuando:
- El donante fuese aproporcionargranulocitosporaféresisyvayana usarse esteroides,o
- Cuandofuesenautilizarse expansoresdel plasma.
Podránaceptarse como donantesalas personasque tengancardiopatíascongénitas
totalmente curadasylosque en losúltimosdosañosesténlibresde síntomasosignosde
fiebre reumáticaysinsecuelascardiacascrónicassecundariasal padecimiento.
6.10.5.10 Las personasque padezcanneumopatíascrónicas,talescomo:bronquitiscrónica
grave,enfisemapulmonaryasmacrónica grave,especialmente si harequeridoingreso](https://image.slidesharecdn.com/leucemia-150617011455-lva1-app6892/85/Leucemia-53-320.jpg)


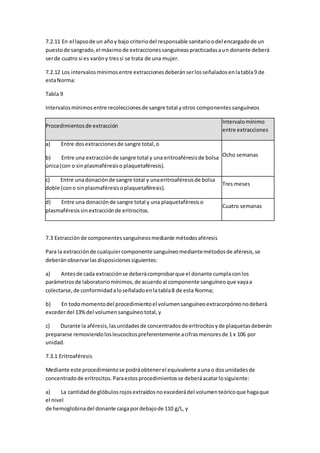
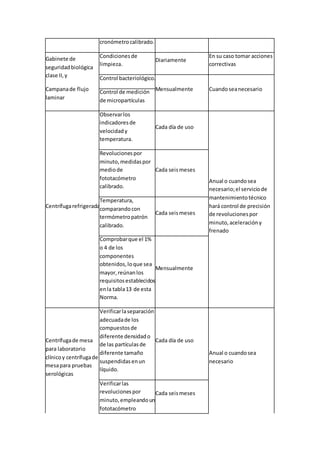
![6.10.6.5.1 Más que por el medicamentoensímismo,el médicoque valore auncandidatoque
hubiese estadooesté bajotratamientofarmacológico,loexcluirátemporal o
permanentemente porlapresenciade laenfermedadsubyacente que condicionóel
tratamiento.
Tratándose de antibióticosempleadosparainfeccionesbanales,se recomiendaunperiodode
diferimientode siete díastrasla suspensióndel fármaco.
6.10.6.5.2 Para finesde exclusióno diferimientode losdonantes,losbancosde sangre ylos
puestosde sangradodeberándisponerde unalistaactualizadade fármacosde uso comúncon
sus correspondientesperiodosde diferimiento.El periodode diferimientose basaráenla
naturalezadel medicamento,sufarmacocinética,modode acciónyenfermedadde base.El
listadose deberáacompañarde instruccionesparalaaceptabilidadde losdonantesydeberá
estaraprobado porel responsable sanitariodel bancode sangre yestará disponible enlos
puestosde sangradoque el banco de sangre tuviese.
6.10.6.6 Se deberándiferirlaspersonasque hubiesenrecibidocualquierade lasvacunaso
inmunizacionesque indicalatabla6 de estaNorma,por loslapsosque lamismaseñala.
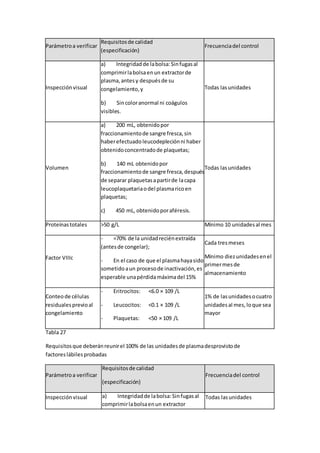
Tabla 6
Vacunacionesmotivo de diferimiento
Tipode vacuna
Diferimientoapartirde
la aplicación
6.10.6.6.1 Cualquiervacunaexperimental. Tres años
6.10.6.6.2 Vacunasantirrábicay contra encefalitisporgarrapata,
aplicadascomoconsecuenciade unaexposiciónde riesgo.
Doce meses
[véase el incisoa) del
apartado 6.10.6.7 de
estaNorma]
6.10.6.6.3 HepatitisporvirusA o virusB e inmunoglobulinas
aplicadasporexposicionesde riesgo.
6.10.6.6.4 Inmunizaciónpasivaconsueroshiperinmunesde origen
animal.
Doce meses
6.10.6.6.5 Vacunaselaboradasconbacteriao virusatenuadoscomo:
Cuatro semanas
- BCG;
- Fiebre amarilla;
- Rubeola;
- Sarampión;
- Poliomielitis(víaoral);
- Parotiditis;
- Fiebre tifoidea(agente
atenuado);
- Cólera(agente
atenuado),e
- Influenza.](https://image.slidesharecdn.com/leucemia-150617011455-lva1-app6892/85/Leucemia-59-320.jpg)