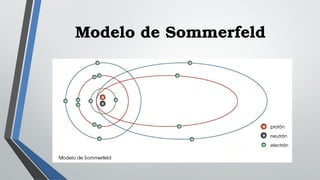
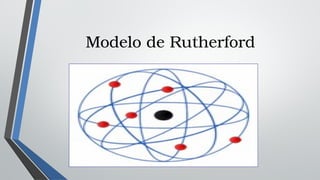
El documento describe varios modelos atómicos históricos, incluyendo el modelo de Dalton que introdujo la idea de átomos, el modelo de Thomson que propuso que los electrones estaban incrustados en un átomo positivo, el modelo de Rutherford que introdujo el concepto de núcleo atómico, el modelo de Bohr que introdujo la cuantización de los orbitales electrónicos, el modelo de Sommerfeld que fue una mejora relativista del modelo de Bohr, y el modelo de Schrödinger que concibió a los electrones como ondas.