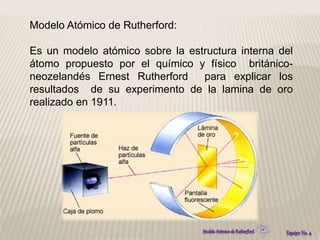
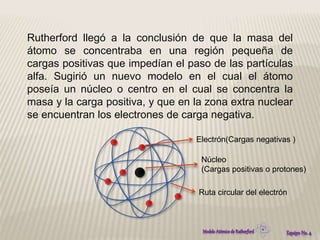
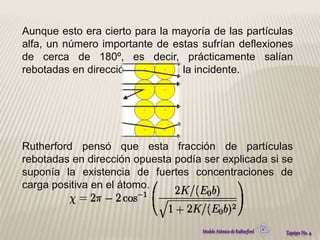
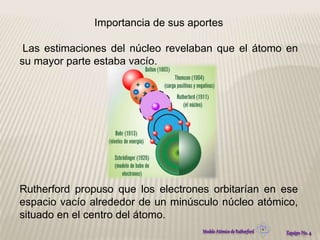
El modelo atómico de Rutherford propuso que los átomos consisten en un núcleo densamente concentrado de carga positiva rodeado por electrones en órbita. Este modelo se basó en los resultados del experimento de Rutherford de 1911, en el que partículas alfa rebotaban después de golpear una delgada lámina de oro, lo que indicaba la presencia de una región densamente cargada en el centro del átomo. El modelo de Rutherford revolucionó la comprensión de la estructura atómica al proponer por primera vez la existencia