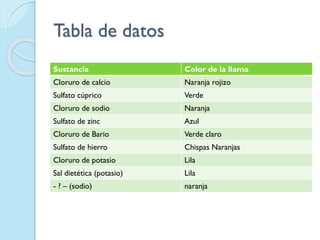
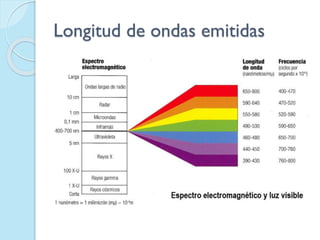
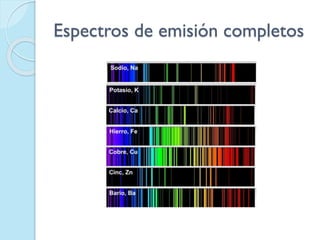
El documento describe los inconvenientes del modelo atómico de Rutherford y cómo Niels Bohr propuso un nuevo modelo atómico para resolverlos. El modelo de Rutherford contradecía la teoría electromagnética de Maxwell y no explicaba satisfactoriamente los espectros atómicos. Bohr propuso que los electrones solo pueden orbitar a ciertas distancias del núcleo con valores cuánticos enteros de energía, y que la energía se libera en forma de luz cuando un electrón cambia de órbita.