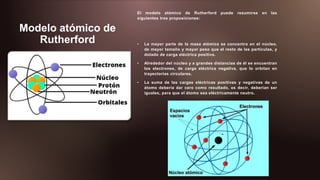
1) El documento presenta los modelos atómicos de Dalton, Thomson, Rutherford, Lewis, Bohr, Sommerfeld y Schrödinger. 2) Dalton propuso que los átomos son indivisibles e indestructibles y que los átomos de diferentes elementos varían en masa y propiedades. 3) Rutherford descubrió que la mayor parte de la masa atómica se concentra en el núcleo y que los electrones orbitan alrededor del núcleo.