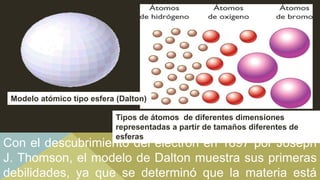
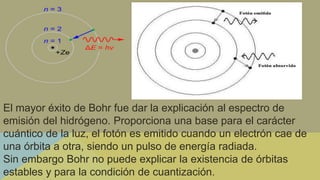
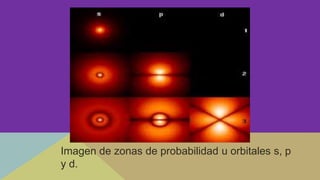
Este documento describe la evolución de los modelos atómicos a través de la historia, comenzando con el modelo de Dalton que propuso que los átomos eran esferas indivisibles. Posteriormente, los modelos de Thomson, Rutherford, Bohr, Schrödinger y otros introdujeron la idea del núcleo atómico y los electrones, y que la energía atómica está cuantizada en niveles discretos. El modelo cuántico actual representa a los electrones como nubes de probabilidad en lugar de órbitas definidas.