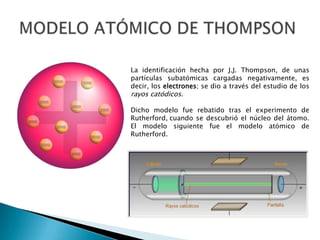
El documento describe la evolución de los modelos atómicos a través de la historia, incluyendo los modelos de Dalton, Thompson, Rutherford, Bohr, Sommerfeld y Schrödinger. Explica que cada modelo se basó en nuevos descubrimientos y conocimientos para ofrecer una mejor comprensión de la estructura del átomo, pasando de ver el átomo como una esfera hueca a entenderlo como un núcleo central rodeado de electrones.