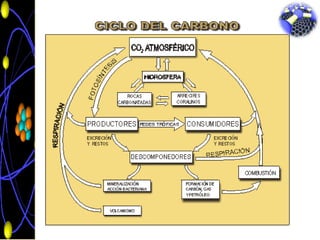
El carbono es un elemento químico que se encuentra en múltiples formas en la naturaleza como carbón, grafito y diamante. Puede formar enlaces simples, dobles o triples con otros átomos, dando lugar a una gran variedad de compuestos como los alcanos, alquenos y alquinos. El carbono es esencial para la vida y se encuentra en la mayoría de compuestos orgánicos, jugando un papel fundamental en el ciclo del carbono en los ecosistemas.